-
哈伯因发明了氮气和氢气合成氨气的方法而获得1918年的诺贝尔化学奖,
N2(g)+3H2(g) 2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
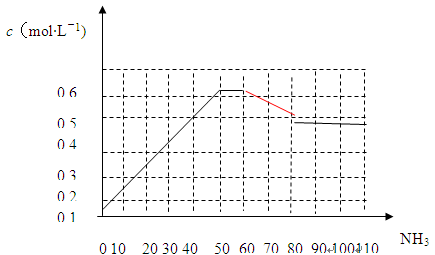
(1)此反应在50~60s时化学平衡常数为K1 =________(列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是________。
A.加入催化剂 B.扩大容器的体积
C.升高温度 D.减小氨气的浓度
在该条件下,氮气的化学反应速率________。(填“变小”、“变大”或“不变”)
(3)该反应在80s后化学平衡常数为K2,则K1________K2(填“>”、“<”或“=”),此时氮气的转化率为________。
(4)若在110s后向该平衡体系中再加入1mol氨气,则再次达平衡后,氨气在平衡体系中的体积分数________。(填“变小”、“变大”或“不变”)
-
[s1] 哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,有关说法正确的是( )
N2+3H2 2NH3
2NH3
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
[s1]15.
-
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
N2+3H2 2NH3
2NH3
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
-
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充人1molN2和3molH2,在一定条件下使该反应发生N2+3H2
 2NH3,有关说法正确的是( )
2NH3,有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
-
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充人1molN2和3molH2,在一定条件下使该反应发生N2+3H2
 2NH3,有关说法正确的是( )
2NH3,有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
-
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,有关说法正确的是 ( )
A、达到化学平衡时,N2将完全转化为NH3
B、达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
-
哈伯因发明了用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3 molH2,在一定条件下使该反应发生。下列说法正确的是
A.达到化学平衡时,N2完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应速率都为零
-
(10分)哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖, 。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
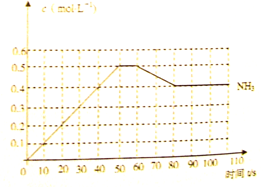
(1)此反应在50~60s时化学平衡常数为 =________(列出计算式不用试算)。
=________(列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是________。
A.加入催化剂 B.扩大容器的体积
C.升高温度 D.减小氨气的浓度
在该条件下,氮气的化学反应速率________(填“变小”、“变大”或“不变”)
(3)该反应在80S后化学平衡常数为 ,则
,则 ________
________ (填“>”,“<”或“=”),此时氮气的转化率为________。
(填“>”,“<”或“=”),此时氮气的转化率为________。
(4)若在110s后向该平衡体系中再加入1mol氨气,则再次达平衡后,氨气在平衡体系中的体积分数________。(填“变小”、“变大”或“不变”)
-
氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。
2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是 ;N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
-
德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ•mol-1
2NH3(g) △H=-92.4kJ•mol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g) CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。
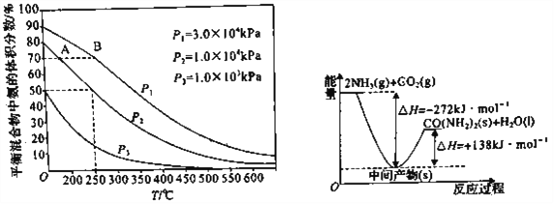
(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:


