-
室温下,关于pH=3 的盐酸和醋酸,下列说法正确的是
A. 等体积的两溶液,导电能力是盐酸强
B. 等体积的盐酸和醋酸溶液加水稀释10倍后,c(Cl- )<c(CH3COO-)
C. 将pH=3 的醋酸溶液稀释后,溶液中所有离子的浓度均降低
D. 中和等体积等浓度的NaOH 溶液,醋酸消耗的体积多
难度: 中等查看答案及解析
-
下列属于碱性氧化物的是
A. CO2 B. KOH C. MgO D. K2CO3
难度: 简单查看答案及解析
-
仪器名称为“容量瓶”的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列属于非电解质的是
A. 氨气 B. 碳酸钾 C. 盐酸 D. 氯气
难度: 简单查看答案及解析
-
下列属于氧化还原反应的是
A. CaO+H2==Ca(OH)2 B. SO2+H2O2==H2SO4
C. Fe2O3+6HCl==2FeCl3+H2O D. NaHCO3+ NaOH==Na2CO3+H2O
难度: 简单查看答案及解析
-
下列分散系能产生“丁达尔效应”的是
A. 氯化钠溶液 B. 硫酸铜溶液 C. 鸡蛋清溶液 D. 酒精溶液
难度: 简单查看答案及解析
-
下列有关物质性质的应用正确的是
A. 铁制容器可以盛装冷的浓硫酸,因为常温下铁和浓H2SO4不反应
B. 二氧化硅是制造太阳能电池板的主要材料
C. 二氧化硫通入酸性KMnO4溶液,溶液紫红色褪去,体现了SO2的漂白性
D. 有机磷农药多为磷酸酯或硫代磷酸酯类物质,肥皂水等碱性物质有利其水解而解毒
难度: 中等查看答案及解析
-
下列表示正确的是
A. 中子数为20的Ar原子:
Ar B. 硝基苯的结构简式:
C. 次氯酸的电子式:
D. CH4的比例模型:
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A. 钠与氧气反应的产物与反应条件有关
B. 金属镁分别能在氮气、氧气、二氧化碳中燃烧
C. 工业上主要采用高温冶炼黄铜矿的方法获得铜
D. 二氧化硫能漂白某些物质,能使紫色石蕊试液先变红后褪色
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 天然气的主要成分是甲烷,是一种可再生的清洁能源
B. 将农业废弃物在一定条件下产生热值较高的可燃气体,是对生物质能的有效利用
C. 若化学过程中断开化学键吸收的能量大于形成化学键所放出的能量,则反应放热
D. 寻找合适的催化剂,使水分解产生氢气的同时放出热量是科学家研究的方向
难度: 简单查看答案及解析
-
下列说法正确的是
A. PH 试纸在检测气体时必须先湿润
B. 容量瓶用蒸馏水洗涤后须烘干才能使用
C. 用苯萃取溴水中的溴时,溴的苯溶液从分液漏斗下口放出
D. 蒸馏完毕后,先停止通冷凝水,再停止加热
难度: 简单查看答案及解析
-
下列说法正确的是
A. H2O 与D2O 互为同素异形体
B. 乙二醇(HOCH2CH2OH)和甘油(CH2OHCHOHCH2OH)互为同系物
C. C5H12的同分异构体有3 种,其沸点各不相同
D. (CH3)2CHCH2CH(CH3)2 的名称是2,5—二甲基戊烷
难度: 简单查看答案及解析
-
在恒温恒容的密闭容器中,发生反应X(g)+2Y(g)
3Z(g) △H=-a kJ·mol-1(a>0),下列说法正确的是
A. 容器内气体的压强不再发生变化,说明反应达到平衡状态
B. 达到化学平衡状态时,反应放出的总热量可能为akJ
C. 当X、Y、Z的浓度之比为1:2:3时,反应达到化学平衡状态
D. 降低反应温度,正反应速率增大,逆反应速率减小
难度: 简单查看答案及解析
-
解释下列实验现象的离子方程式正确的是
A. FeI2 溶液中通入过量Cl2: 2Fe2++2I-+ 2Cl2== 2Fe3++I2+ 4Cl-
B. 新制氯水中滴加石灰水后,黄绿色褪去:C12+Ca(OH)2=Ca2++Cl-+C1O-+H2O
C. 次氯酸钙中通入过量SO2时:ClO- + SO2 + H2O = SO42- + Cl- + 2H+
D. SO2使酸性KMnO4溶液褪色:5SO2+2H2O+2MnO4-=5SO42-+2Mn2++4H+
难度: 困难查看答案及解析
-
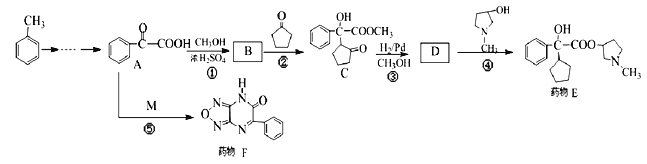
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W、X、Y、Z原子的最外层电子数之和为21,下列说法中不正确的是
A. 原子半径:X>Y>W
B. 简单阴离子的还原性:Z>W
C. 气态氢化物的稳定性:W>Y
D. 氧化物对应水化物的酸性:Z> Y
难度: 简单查看答案及解析
-
下列说法正确的是
A. 乙烯、氯乙烯、聚氯乙烯均能使溴水褪色
B. 间二甲苯只有一种结构,说明苯不是单双键交替的结构
C. 等物质的量的乙烯和乙醇完全燃烧,乙烯消耗的氧气多
D. 煤的气化就是把煤转化为可燃性气体的过程,该气体可用来合成液态烃及甲醇等含氧有机物
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 油脂在碱性条件下水解可生成高级脂肪酸盐和甘油
B. 淀粉、纤维素和蔗糖都属于糖类,一定条件下水解都只生成葡萄糖
C. 蛋白质在人体内先水解成各种氨基酸,各种氨基酸再彼此结合成人体需要的蛋白质
D. 二氧化碳和环氧丙烷(
)在催化剂作用下可生成一种可降解的塑料
难度: 简单查看答案及解析
-
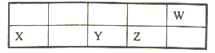
微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。如图是一种微生物燃料电池的工作原理示意图,下列有关说法不正确的是
A. B电极是正极
B. 电池内H+从左侧向右侧迁移
C. A电极的电极反应式: CH3COOH + 8e-+ 2H2O=2CO2 +8H+
D. 该电池可利用有机废水等有机废弃物作为燃料
难度: 简单查看答案及解析
-
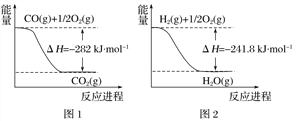
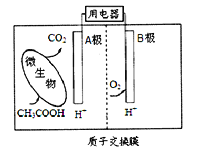
根据合成氨反应的能量变化示意图,下列有关说法正确的是
A. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ·mol-1
B. 断裂0.5moIN2 (g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3 (l)= N2(g)+3H2(g) △H=2(b+c-a) kJ·mol-1
D. 若合成氨反应使用催化剂,反应放出的热量增多
难度: 简单查看答案及解析
-
下列说法正确的是
A. H2O的沸点比H2S高,所以H2O 比H2S 更稳定
B. 干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同
C. N2和CCl4中,每个原子的最外层都具有8电子稳定结构
D. NaHCO3受热分解的过程中,只有离子键被破坏
难度: 简单查看答案及解析
-
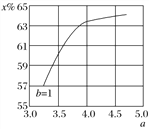
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
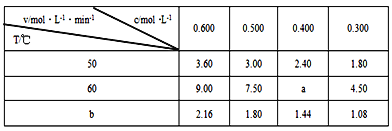
A. a=6.00
B. 同时改变反应温度和蔗糖的浓度,v可能不变
C. b<50
D. 50℃时,经过5s蔗糖浓度减少一半
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,28g 乙烯和丙烯的混合物中含有C-H 键的数目为4NA
B. 0.1 mol•L-1Na2CO3溶液中含有的CO32-数目小于0.1 NA
C. 0.1mol 的SO2 与ImolO2 充分反应,转移的电子数为0.2 NA
D. 常温常压下,19g 羟基(—18OH) 中所含的中子数为9 NA
难度: 简单查看答案及解析
-
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与 pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是
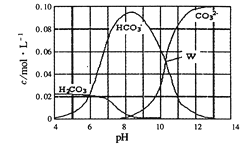
A. W点所示的溶液中:c(Na+)+c(H+)=4c(CO32-)+c(OH-)+c(Cl-)
B. pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol/L
C. pH=8的溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D. pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
难度: 困难查看答案及解析
-
碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(含有质量分数为8%的TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下:(已知TeO2微溶于水,易溶于强酸和强碱)下列有关说法不正确的是
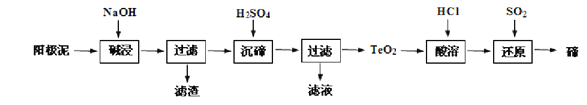
A. 将阳极泥研磨、反应适当加热都有利于提高“碱浸”的速率和效率
B. “沉碲”时为使碲元素沉淀充分,应加入过量的硫酸
C. “碱浸”时发生主要反应的离子方程式为TeO2+2OH-=TeO32-+H2O
D. 若提取过程碲元素的回收率为90%,则处理1Kg 这种阳极泥最少需通入标准状况下SO220.16L
难度: 困难查看答案及解析
-
在Na+浓度为1.0 mol•L-1的某澄清溶液中,还可能含有K+、Mg2+、Fe3+、Ba2+、CO32-、SO32-、SiO32-、Cl-、SO42-等离子,取该溶液100mL 进行下图连续实验(所加试剂均过量,气体全部逸出)。下列说法不正确的是
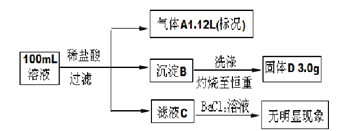
A. 原溶液中一定不存在Mg2+、Fe3+、Ba2+、SO42-
B. 在l00mL原溶液中加入足量BaCl2溶液,至少可生成沉淀20.5g
C. 为确定原溶液中是否含有Cl-,可取滤液C,加入AgNO3和稀HNO3溶液
D. 原溶液一定存在K+,c(K+)可能为1.5 mol•L-1
难度: 困难查看答案及解析
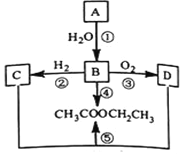
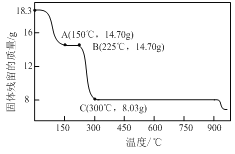
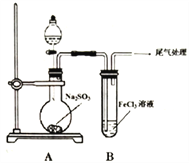
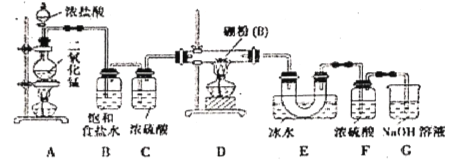
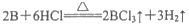 ;③硼能与氢氧化钠溶液反应(与铝性质相似)。
;③硼能与氢氧化钠溶液反应(与铝性质相似)。