-
(2015秋•上海校级月考)人体正常的血红蛋白中含有亚铁离子,若误食亚硝酸盐NaNO2,则导致血红蛋白中Fe2+转化为Fe3+,从而使血红蛋白中毒,服用维生素C可解除亚硝酸盐中毒,则下列说法正确的是( )
A.维生素C可将 Fe2+还原成为Fe3+
B.亚硝酸盐被氧化
C.亚硝酸盐是氧化剂
D.维生素C是氧化剂
难度: 简单查看答案及解析
-
(2013秋•上海校级期中)下列有关的化学用语中正确的是( )
A.氮分子的电子式:
B.氮原子电子排布式:1s22s22p5
C.氮分子的结构式::N≡N:
D.氧原子最外层轨道表示式:
难度: 简单查看答案及解析
-
(2015秋•上海校级月考)“化学是一门中心学科,与社会发展的需要有密切的关系”.下列有关叙述不正确的是( )
A.为了防止食品受潮及富脂食品氧化变质,常在包装袋中放入硅胶和硫酸亚铁( )
B.积极推行和使用能被微生物降解的新型聚合物材料
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.废旧电池应集中回收,不能填埋处理
难度: 简单查看答案及解析
-
(2015秋•上海校级月考)下列判断正确的是( )
A.元素周期表中查得的相对原子质量为同位素的相对原子质量
B.化学键的变化一定会引起化学反应的变化
C.只含有共价键的物质一定是共价化合物
D.常温时pH=7的溶液一定是中性溶液
难度: 简单查看答案及解析
-
(2015秋•上海校级月考)臭氧层中氧分解历程如图所示,下列说法正确的是( )
总反应:O3+O→2O2
催化反应:①O3+Cl→O2+ClO;②ClO+O→Cl+O2.
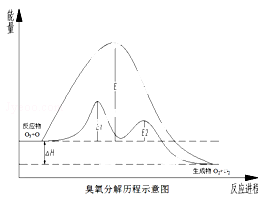
A.催化反应①②均为放热反应
B.催化剂不能改变该反应的反应热
C.ClO是该反应的催化剂
D.在该反应过程中没有化学键的断裂与生成
难度: 中等查看答案及解析
-
(2015秋•上海校级月考)下列离子组能大量共存的是( )
A.含有大量NH4+的溶液中:HCO3﹣、K+、Na+、Cl﹣
B.酚酞呈红色的溶液中:Na+、AlO2﹣、K+、HCO3﹣
C.含大量H+的溶液中:Na+、Cl﹣、NO3﹣、SO32﹣
D.加入Fe能放出H2的溶液中:Na+、K+、NO3﹣、SO42﹣
难度: 中等查看答案及解析
-
(2014•黄浦区一模)a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是( )
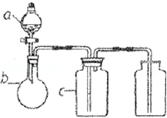
编号
气体
a
b
c
A
SO2
浓H2SO4
铜屑
饱和Na2SO3溶液
B
CO2
稀HNO3
碳酸钙
饱和NaHCO3
C
NO
稀HNO3
铜屑
H2O
D
NO2
浓HNO3
铜屑
NaOH溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
(2006•沈阳一模)下列叙述中指定粒子数目一定大于NA的是( )
A.11.2L N2和NO的混合气体所含的原子数
B.12g 14C中所含的碳原子数
C.28g铁在反应中作还原剂时,失去电子的数目
D.1L 0.1mol/L CH3COOH溶液中所含分子总数
难度: 简单查看答案及解析
-
(2012•虹口区二模)课外学习小组为检验溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使红色石蕊试纸变蓝.由该实验能够得到的正确结论是( )
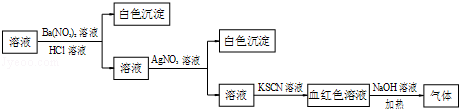
A.原溶液中一定含有SO42﹣离子
B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl﹣离子
D.原溶液中一定含有Fe3+离子
难度: 中等查看答案及解析
-
(2015•崇明县二模)从海带中提取碘,可经过如图实验步骤完成.下列有关说法正确的是( )

A.灼烧过程中使用的玻璃仪器有酒精灯、坩埚、玻璃棒
B.氧化过程中发生反应的离子方程式为:2I﹣+H2O2→I2+2OH﹣
C.检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明有碘单质
D.分液时,先打开活塞放出下层液体,再关闭活塞倒出上层液体
难度: 中等查看答案及解析
-
(2015秋•上海校级月考)据最新报道,科学家发现了如下反应:O2+PtF6→O2(PtF6),已知O2(PtF6)为离子化合物,其中的Pt为+5价,(PtF6)为某价态的原子团,对于此反应下列说法正确的是( )
A.在此反应中,O2氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1 mol O2(PtF6)则转移1 mol电子
D.在O2(PtF6)中不存在共价键
难度: 困难查看答案及解析
-
(2014春•泸县校级期中)迷迭香酸是从蜂花属植物中提取得到的酸性物质,迷迭香酸的分子结构如图,下列叙述正确的是( )
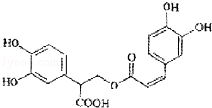
A.迷迭香酸属于芳香族化合物,分子式C18H18O8
B.迷迭香酸含有碳碳双键、羟基、羧基、苯环和酯基的结构
C.1mol迷迭香酸最多能和含6mol Br2的浓溴水发生反应
D.1mol迷迭香酸最多与含5mol NaOH的水溶液完全反应
难度: 中等查看答案及解析
-
(2015秋•上海校级月考)甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电源正、负极相连的两根石墨棒C1、C2插入乙,把分别与直流电源正、负极相连的石墨棒C3、铁片插入丙.则下列叙述正确的是( )
A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲、乙中溶液的pH逐渐升高,丙中溶液的pH逐渐减小
难度: 中等查看答案及解析
-
(2014春•成都校级期末)下列情况下,反应速率相同的是( )
A.等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和CH3COOH分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
难度: 中等查看答案及解析
-
(2013春•天心区校级期末)将5.1g镁铝合金,投入到500mL 2mol/L的盐酸中,金属完全溶解,再加入4mol/L 的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是( )
A.200 mL B.250 mL C.425 mL D.560 mL
难度: 中等查看答案及解析
-
(2007•深圳二模)下列离子方程式正确的是( )
A.向Mg(HC03)2溶液中加入过量的NaOH溶液:Mg2++2HC03﹣+20H﹣═MgC03↓+C032﹣+2H20
B.向NH4Al(S04)2溶液中滴入Ba(OH)2溶液使SO42﹣反应完全:2Ba2++40H﹣+Al3++2SO42﹣═2BaS04↓+Al02﹣+2H20
C.足够的C02通入饱和碳酸钠溶液中:C02+CO32﹣+H20=2HC03﹣
D.向Fe(N03)2溶液中加入稀盐酸:3Fe2++4H++N03﹣═3Fe3++NO↑+2H20
难度: 中等查看答案及解析
-
(2014•浦东新区一模)环戊二烯在一定条件下发生二聚反应.该反应涉及“1,4﹣加成”原理,两个环戊二烯分子的五元环均得以保留.反应中新生成的共价键的编号(如图)是( )
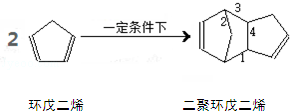
A.1 B.2 C.3 D.4
难度: 中等查看答案及解析
-
(2013秋•金山区校级期中)向10mL 0.1mol/L Na2CO3溶液中逐滴滴加V mL 0.1mol/L HCl溶液,下列有关滴定过程中粒子浓度关系正确的是( )
A.当V=0时,[OH﹣]=[H+]+[HCO3﹣]+2[H2CO3]
B.当V=5时,[Na+]+[H+]=2[CO32﹣]+[HCO3﹣]+[OH﹣]
C.当V=10时,[Cl﹣]=[CO32﹣]+[HCO3﹣]+[H2CO3]
D.当V=15时,[Na+]=[Cl﹣]>[HCO3﹣]>[OH﹣]>[H+]
难度: 中等查看答案及解析
-
(2015秋•上海校级月考)下列相关实验中,由“操作和现象”得出的“结论”不正确的是( )
操作和现象
结论
A
取某溶液少许,加入酸化的Ba(NO3)2溶液,产生白色沉淀
该溶液一定含SO42﹣
B
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀
结合H+的能力:CO32﹣<AlO2﹣
C
某溶液加入盐酸产生使石灰水变浑浊的无色无味气体
该溶液肯定含HCO3﹣、CO32﹣中的一种或二种
D
测定等浓度的Na2CO3和Na2SO3溶液的pH;前者pH比后者的大;
非金属性:S>C
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
(2015•嘉峪关校级三模)ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
A.1:1 B.2:1 C.1:2 D.2:3
难度: 中等查看答案及解析
-
(2014•虹口区一模)部分弱酸的电离平衡常数如表,下列离子反应可以发生的是( )
弱酸
H2CO3
H2SO3
HClO
电离平衡常数
(25℃)
K1=4.30×l0﹣7
K1=1.54×l0﹣2
K=2.95×l0﹣8
K2=5.61×l0﹣11
K2=1.02×l0﹣7
A.ClO﹣+CO2+H2O→HClO+HCO3﹣
B.SO32﹣+CO2+H2O→HSO3﹣+HCO3﹣
C.2ClO﹣+SO2+H2O→2HClO+SO32﹣
D.2HSO3﹣+CO32﹣→2SO32﹣+CO2+H2O
难度: 中等查看答案及解析
-
(2015秋•上海校级月考)把CO2和NO组成的混合气体80mL,缓缓通过足量的Na2O2,气体体积缩小为原混合气体的
,则CO2和NO的体积比为( )
A.1:1 B.2:3 C.8:9 D.9:2
难度: 中等查看答案及解析
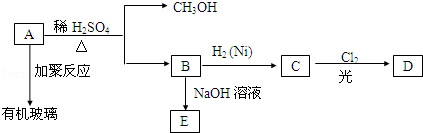
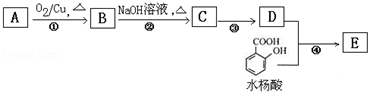
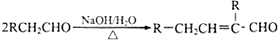 ,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下:
,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下: