-
(2015•普陀区一模)某化学小组的同学模拟工业制硝酸设计了如下图所示的装置.已知:
CaCl2+nH2O→CaCl2•nH2O; CaCl2+8NH3→[Ca(NH3)8]Cl2
根据题意完成下列填空:
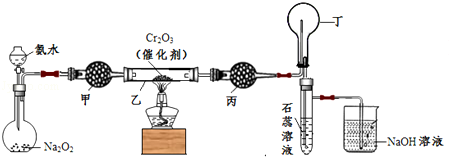
(1)分液漏斗中氨水的浓度为9.0mol/L.现用质量分数为0.35、密度为0.88g/cm3的氨水配制9,.0mol/L的氨水100mL,需要的定量仪器有 (选填编号).
a.100mL容量瓶 b.10mL量筒 c.50mL量筒 d.电子天平
(2)受热时,乙中反应的化学方程式为 .
(3)实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,可观察到的现象有 .
(4)干燥管甲的作用是 ;丙中盛放的药品为 (选填下列编号),其目的是 .
a.浓H2SO4 b.无水CaCl2 c.碱石灰 d.无水CuSO4
(5)丁中除了NO之外,还可能存在的气体有 (填写化学式).烧杯中发生反应的化学方程式 、 .
-
(本题共12分)某化学小组的同学模拟工业制硝酸设计了如下图所示的装置。已知:
CaCl2+ nH2O→CaCl2·nH2O;CaCl2+ 8NH3→[Ca(NH3)8]Cl2
根据题意完成下列填空:
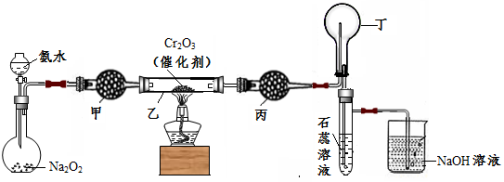
33.分液漏斗中氨水的浓度为9.0mol/L。现用质量分数为0.35、密度为0.88g/cm3的氨水配制9.0mol/L的氨水100mL,需要的定量仪器有 (选填编号)。
a.100mL容量瓶 b.10mL量筒 c.50mL量筒 d.电子天平
34.受热时,乙中反应的化学方程式为 。
35.实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,可观察到的现象有 。
36.干燥管甲的作用是 ;丙中盛放的药品为 (选填下列编号),其目的是 。
a.浓H2SO4 b.无水CaCl2 c.碱石灰 d.无水CuSO4
37.丁中除了NO之外,还可能存在的气体有 (填写化学式)。烧杯中发生反应的化学方程式 、 。
-
某化学小组的同学模拟工业制硝酸设计了如下图所示的装置。已知:
CaCl2+nH2O→CaCl2·nH2O;CaCl2+8NH3→[Ca(NH3)8]Cl2,根据题意完成下列填空:
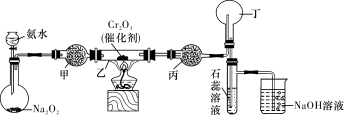
(1)分液漏斗中氨水的浓度为9.0 mol/L。现用质量分数为35%、密度为0.88 g/cm3的氨水配制9.0 mol/L的氨水100 mL,需要的定量仪器有 (选填编号)。
a.100 mL容量瓶 b.10 mL量筒 c.50 mL量筒 d.电子天平
(2)受热时,乙中反应的化学方程式为 。
(3)实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,可观察到的现象有 。
(4)干燥管甲的作用是 ;丙中盛放的药品为 (选填下列编号),其目的是 。
a.浓H2SO4 b.无水CaCl2 c.碱石灰 d.无水CuSO4
(5)丁中除了NO之外,还可能存在的气体有 (填写化学式)。烧杯中发生反应的化学方程式 。
-
某化学小组的同学模拟工业制硝酸设计了如下图所示的装置。已知:
CaCl2+ nH2O→CaCl2·nH2O;CaCl2+ 8NH3→[Ca(NH3)8]Cl2
根据题意完成下列填空:
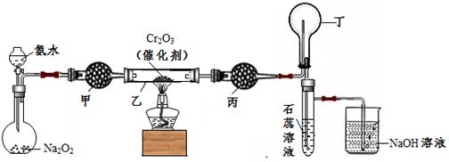
(1)分液漏斗中氨水的浓度为9.0mol/L。现用质量分数为35%、密度为0.88g/cm3的氨水配制9.0mol/L的氨水100mL,需要的定量仪器有 (选填编号)。
a.100mL容量瓶 b.10mL量筒 c.50mL量筒 d.电子天平
(2)受热时,乙中反应的化学方程式为 。
(3)实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,可观察到的现象有 。
(4)干燥管甲的作用是 ;丙中盛放的药品为 (选填下列编号),其目的是 。
a.浓H2SO4 b.无水CaCl2 c.碱石灰 d.无水CuSO4
(5)丁中除了NO之外,还可能存在的气体有 (填写化学式)。烧杯中发生反应的化学方程式 、 。
-
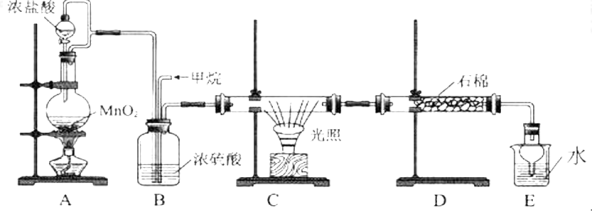
利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
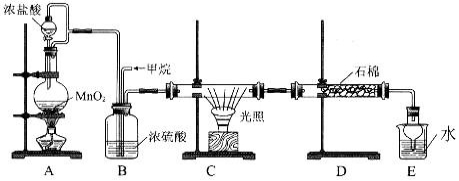
(1)A 中制取 C12 反应的离子方程式是 。
(2)B 装置中浓硫酸的作用是 。
(3)D 装置中的石棉上吸附着潮湿的 KI 粉末,其作用是 。
(4)E 装置的作用是 (填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E 装置中除了有盐酸生成外,还含有有机物,从 E 中分离出盐酸的最佳方法是 。
-
氨气是一种重要化合物,在工农业生产、生活中有着重要应用。
(1)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):
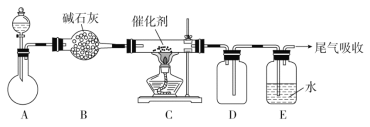
①检查装置气密性的方法是__________________________,D的作用是________。
A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是________(填化学式)。
②反应后,装置E中除存在较多的H+外,还可能存在的一种阳离子是____________,试设计实验证明这种离子的存在:__________________________________________。
③下列哪个装置可以同时起到装置D和E的作用________(填代号)。
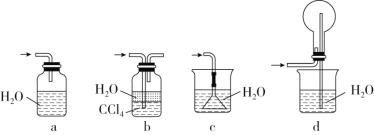
(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________________________,该反应生成的还原产物的化学键类型是________。
-
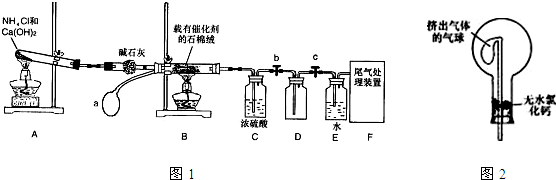
氨气是一种重要化合物,在工农业生产、生活中有着重要作用。
(1)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):
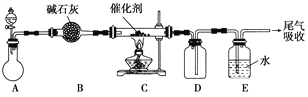
①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是________。
②C装置中发生反应的化学方程式为________________。
③反应后,装置E中除存在较多的H+外,还可能存在的一种离子是________,试设计实验证明这种离子的存在_____________________。
④下列哪些装置可以同时起到装置D和E的作用________(填代号)。
(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________________(不必配平),该反应生成的还原产物的化学键类型是________。
-
利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
(1)A中制取C12反应的离子方程式是___________________。
(2)B装置中浓硫酸的作用是______________。
(3)D装置中的石棉上吸附着潮湿的KI粉末,其作用是_____________。
(4)E装置的作用是______________(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
-
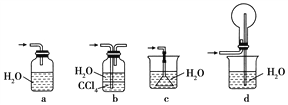
某化学小组模拟工业生产制取HNO3,设计如图1所示装置,其中a为一个可持续鼓入空气的橡皮球.请回答下列问题:
(1)写出装置A中主要反应的化学方程式______ 2NH3↑+CaCl2+2H2O
-
某课外小组模拟上述部分过程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)
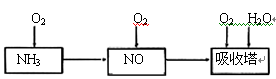
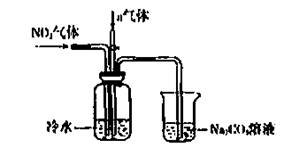
(1)工业上用氨气制取NO的化学方程式是________。
(2)连接好装置后,首先进行的操作是________。
(3)通入a气体的目的是________.
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是
2NO2+Na2CO3=====NaNO2+________+________
(5)已知:温度低于21.15°C时,NO2几乎全部转变为N2O2。工业上可用N2O4与水反应来提高硝酸产率。N2O4与a气体在冷水中生成硝酸的化学方程式是________。
 (6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K=________。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为________。
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K=________。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为________。












