-
(2015秋•上海校级月考)精制氯化钾在工业上可用于制备各种含钾的化合物.完成下列填空:
(1)在氯化钾中含有Fe3+、SO42﹣、Br﹣等杂质离子,可按如下步骤进行精制,完成各步内容.
①溶解;②加入试剂至Fe3+、SO42﹣沉淀完全,煮沸;
③ ;④加入盐酸调节pH;⑤ (除Br﹣);⑥蒸干灼烧.步骤②中,依次加入的沉淀剂是NH3•H2O、 、 .证明Fe3+已沉淀完全的操作是 .
(2)人们尝试用工业制纯碱原理来制备K2CO3.他向饱和KCl溶液中依次通入足量的 和 两种气体,充分反应后有白色晶体析出.将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊.写出生成白色晶体的化学方程式: .分析该方法得不到K2CO3的原因可能是 .
(3)科学家最近开发了一种用氯化钾制氢氧化钾的方法.其反应可分为5步(若干步已合并,条件均省略).请写出第⑤步反应的化学方程式.
第①、②步(合并):2KCl+4HNO3→2KNO3+Cl2+2NO2+2H2O
第③、④步(合并):4KNO3+2H2O→4KOH+4NO2+O2
第⑤步:
总反应:4KCl+O2+2H2O→4KOH+2Cl2与电解法相比,该方法的优势可能是 .
高三化学填空题困难题查看答案及解析
-
精制氯化钾在工业上可用于制备各种含钾的化合物。完成下列填空:
(1)工业氯化钾中含有Fe3+、SO42—、Br—等杂质离子,可按如下步骤进行精制,完成各步内容。
①溶解;②加入试剂至Fe3+、SO42—沉淀完全,煮沸;③_____________________;④加入盐酸调节pH;
⑤___________________(除Br—);⑥蒸干灼烧。
步骤②中,依次加入的沉淀剂是NH3·H2O、________、________。
证明Fe3+已沉淀完全的操作是_________________________________________________。
(2)有人尝试用工业制纯碱原理来制备K2CO3。他向饱和KCl溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。
写出生成白色晶体的化学方程式:___________________________________________。
分析该方法得不到K2CO3的原因可能是_______________________________________。
(3) 用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法。氢氧化钾在_________极区产生。为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止_______(填“阴”、“阳”或“所有”)离子通过。
(4)科学家最近开发了一种用氯化钾制氢氧化钾的方法。其反应可分为5步(若干步已合并,条件均省略)。请写出第⑤步反应的化学方程式。
第①、②步(合并):2KCl + 4HNO3 → 2KNO3 + Cl2 + 2NO2 + 2H2O
第③、④步(合并):4KNO3 + 2H2O → 4KOH + 4NO2 + O2
第⑤步:____________________________________________
总反应:4KCl + O2 + 2H2O → 4KOH + 2Cl2
与电解法相比,该方法的优势可能是______________。
高三化学实验题极难题查看答案及解析
-
Ⅰ.工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅.
(1)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______(填序号)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为______.(填序号)(①饱和Na2CO3溶液 ②饱和K2CO3溶液 ③75%乙醇 ④四氯化碳)
(2)如图是离子交换膜(允许钠离子通过,不允许氢氧根与氯离子通过)法电解饱和食盐水示意图,电解槽阳极产生的气体是______;NaOH溶液的出口为______(填字母);精制饱和食盐水的进口为______(填字母);干燥塔中应使用的液体是______.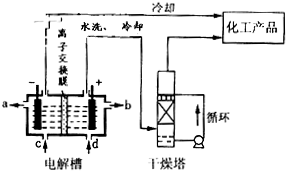
Ⅱ.多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注.
(1)SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为______ SiO2+4HCl高三化学解答题中等难度题查看答案及解析
-
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。完成下列填空:
(1)写出上述制备小苏打的化学方程式__________
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤 ②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是___________(选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是________________;滤渣的主要成分是________________。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。选甲基橙而不选酚酞作为指示剂的原因是_________。
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果__。(选填“偏高”、“偏低”或“无影响”)
高三化学简答题困难题查看答案及解析
-
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
完成下列填空:
(1)写出上述制备小苏打的化学方程式。____________________
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是__________(选填编号)
a.①析出的氯化铵纯度更高 b.②析出的
氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是____________________________。
滤渣的主要成分是_________________、_________________。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。
实验中所需的定量仪器除电子天平外,还有__________________。
样品中NaHCO3的质量分数为__________________。(保留1位小数)
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果______________。(选填“偏高”、“偏低”或“无影响”)
高三化学填空题困难题查看答案及解析
-
(13分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质,不符合电解要求,因此必须经过精制.某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸
调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
________________.
(3)步骤2中,判断加入BaCl2已过量的方法是:_______________________________
_______________________.
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是
________________________________________________________________________.
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
同学转移溶液的示意图,图中的两处错误是:
________________________________________________
________________________________________________.
若在定容时仰视,则所配溶液的浓度_____________________________________
0.2 mol/L(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是: ________________________________________________________________________.
高三化学实验题中等难度题查看答案及解析
-
氯酸钾是常见的氧化剂,用于制造火药、烟火,工业上用石灰乳氯化法制备氯酸钾的流程如下所示:
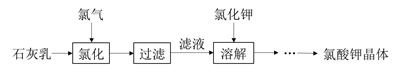
已知:氯化过程主要发生反应6Ca(OH)2 + 6Cl2
5CaCl2+Ca(ClO)2+6H2O
完成下列填空:
(1)工业生产氯气的方法是__________________。
(2)氯化过程需要控制较高温度,其目的有:
①_____________________________; ②减少 Cl2 与 Ca(OH)2 之间的副反应。
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应的化学方程式:__________________________________________________。
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是_________________。
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如下表:
加热次数
第一次
第二次
第三次
第四次
剩余固体质量(g)
c
d
e
e
①进行加热操作时,应将固体置于_________(填仪器名称)中。
②该实验不必进行第五次加热的原因是_______________________________________。
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况。
_______________________________________________________________
高三化学实验题中等难度题查看答案及解析
-
硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。某研究小组设计制备SnSO4与SnCl4路线如下。完成下列填空:
(一)制备SnSO4
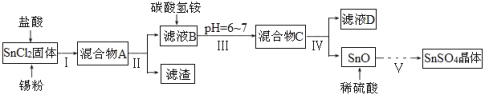
已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
(1)SnCl2用盐酸进行酸溶的原因是_____________________。
(2)步骤Ⅱ中用到的玻璃仪器除烧杯外还有____________;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为______________。
(3)步骤Ⅴ依次操作:蒸发浓缩、_________、_________、洗涤、低温干燥,即可得到产物。
(二)制备SnCl4
实验室用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。实验装置如图所示:
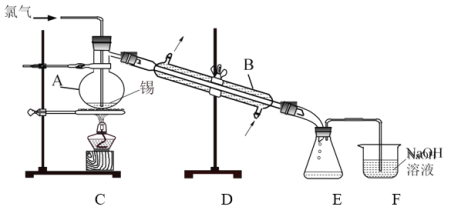
(4)仪器B的名称______________。
(5)图中尾气处理装置不够完善,改进的方法是:________________(可以画图,也可以用文字表述,需注明仪器、试剂及连接位置等)。
(6)若反应中用去锡粉11.9 g,反应后在锥形瓶中收集到23.8 g SnCl4,则SnCl4的产率为__________。
高三化学实验题中等难度题查看答案及解析
-
(2015秋•上海校级月考)人体正常的血红蛋白中含有亚铁离子,若误食亚硝酸盐NaNO2,则导致血红蛋白中Fe2+转化为Fe3+,从而使血红蛋白中毒,服用维生素C可解除亚硝酸盐中毒,则下列说法正确的是( )
A.维生素C可将 Fe2+还原成为Fe3+
B.亚硝酸盐被氧化
C.亚硝酸盐是氧化剂
D.维生素C是氧化剂
高三化学选择题简单题查看答案及解析
-
过碳酸钠是过氧化氢与碳酸钠通过反应而制得,主要用作漂白剂和氧化剂,以及去污剂、清洗剂、杀菌剂一种制备工艺如下。

(1)工业Na2CO3中含有Fe3+、Cu2+、Mn2+等杂质,使用前必须精制,原因是_______。
(2)一种精制流程为:

流程中通入过量CO2的目的是________,300℃时发生反应的化学方程式________。
(3)反应器温度维持在15℃左右,加入反应物,反应半小时即可得到大量晶体,如果反应温度过高,可能发生的副反应是________,如果温度过低造成的影响是_________。
(4)MgSO4和Na2SiO3的混合物是常见的稳定剂,关于稳定剂的说法中正确的是________。
A.稳定剂反应生成的沉淀将过碳酸钠包住,在其外表面形成涂层,使过碳酸钠与外界隔离
B.稳定剂可以结合使过氧化氢分解的有害离子
C.稳定剂宜多不宜少,通过改变溶液的酸碱性,使过碳酸钠更稳定
(5)过碳酸钠应如何保存_______________。
高三化学简答题困难题查看答案及解析