-
精制氯化钾在工业上可用于制备各种含钾的化合物。完成下列填空:
(1)工业氯化钾中含有Fe3+、SO42—、Br—等杂质离子,可按如下步骤进行精制,完成各步内容。
①溶解;②加入试剂至Fe3+、SO42—沉淀完全,煮沸;③_____________________;④加入盐酸调节pH;
⑤___________________(除Br—);⑥蒸干灼烧。
步骤②中,依次加入的沉淀剂是NH3·H2O、________、________。
证明Fe3+已沉淀完全的操作是_________________________________________________。
(2)有人尝试用工业制纯碱原理来制备K2CO3。他向饱和KCl溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。
写出生成白色晶体的化学方程式:___________________________________________。
分析该方法得不到K2CO3的原因可能是_______________________________________。
(3) 用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法。氢氧化钾在_________极区产生。为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止_______(填“阴”、“阳”或“所有”)离子通过。
(4)科学家最近开发了一种用氯化钾制氢氧化钾的方法。其反应可分为5步(若干步已合并,条件均省略)。请写出第⑤步反应的化学方程式。
第①、②步(合并):2KCl + 4HNO3 → 2KNO3 + Cl2 + 2NO2 + 2H2O
第③、④步(合并):4KNO3 + 2H2O → 4KOH + 4NO2 + O2
第⑤步:____________________________________________
总反应:4KCl + O2 + 2H2O → 4KOH + 2Cl2
与电解法相比,该方法的优势可能是______________。
高三化学实验题极难题查看答案及解析
-
(2015秋•上海校级月考)精制氯化钾在工业上可用于制备各种含钾的化合物.完成下列填空:
(1)在氯化钾中含有Fe3+、SO42﹣、Br﹣等杂质离子,可按如下步骤进行精制,完成各步内容.
①溶解;②加入试剂至Fe3+、SO42﹣沉淀完全,煮沸;
③ ;④加入盐酸调节pH;⑤ (除Br﹣);⑥蒸干灼烧.步骤②中,依次加入的沉淀剂是NH3•H2O、 、 .证明Fe3+已沉淀完全的操作是 .
(2)人们尝试用工业制纯碱原理来制备K2CO3.他向饱和KCl溶液中依次通入足量的 和 两种气体,充分反应后有白色晶体析出.将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊.写出生成白色晶体的化学方程式: .分析该方法得不到K2CO3的原因可能是 .
(3)科学家最近开发了一种用氯化钾制氢氧化钾的方法.其反应可分为5步(若干步已合并,条件均省略).请写出第⑤步反应的化学方程式.
第①、②步(合并):2KCl+4HNO3→2KNO3+Cl2+2NO2+2H2O
第③、④步(合并):4KNO3+2H2O→4KOH+4NO2+O2
第⑤步:
总反应:4KCl+O2+2H2O→4KOH+2Cl2与电解法相比,该方法的优势可能是 .
高三化学填空题困难题查看答案及解析
-
Ⅰ.工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅.
(1)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______(填序号)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为______.(填序号)(①饱和Na2CO3溶液 ②饱和K2CO3溶液 ③75%乙醇 ④四氯化碳)
(2)如图是离子交换膜(允许钠离子通过,不允许氢氧根与氯离子通过)法电解饱和食盐水示意图,电解槽阳极产生的气体是______;NaOH溶液的出口为______(填字母);精制饱和食盐水的进口为______(填字母);干燥塔中应使用的液体是______.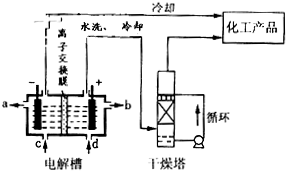
Ⅱ.多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注.
(1)SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为______ SiO2+4HCl高三化学解答题中等难度题查看答案及解析
-
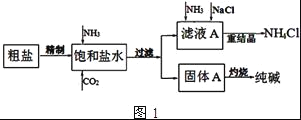
纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
完成下列填空:
已知:粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子.
(1)精制除杂的步骤顺序是____→___→____→____→____ (填字母编号).
a 粗盐溶解 b 加入盐酸调pH c 加入Ba(OH)2溶液 d 加入Na2CO3溶液 e 过滤
(2)向饱和食盐水中先通入NH3,后通入CO2,理由是______.在滤液a中通入NH3和加入精盐的目的是______.
(3)请在图1流程图中添加两条物料循环的路线.____
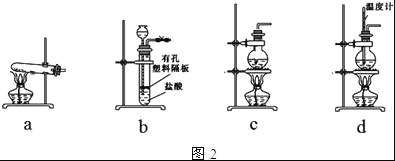
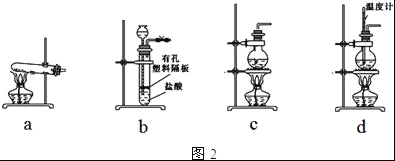
(4)图2装置中常用于实验室制备CO2的是__(填字母编号);用c装置制备NH3,烧瓶内可加入的试剂是___(填试剂名称).
(5)一种天然碱晶体成分是aNa2CO3•bNa2SO4•cH2O,利用下列提供的试剂,设计测定Na2CO3质量分数的实验方案.请把实验方案补充完整:
供选择的试剂:稀H2SO4、BaCl2溶液、稀氨水、碱石灰、Ba(OH)2溶液
①______.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
高三化学实验题中等难度题查看答案及解析
-
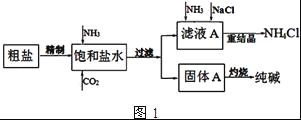
纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
完成下列填空:
已知:粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子.
(1)精制除杂的步骤顺序是____→___→____→____→____ (填字母编号).
a 粗盐溶解 b 加入盐酸调pH c 加入Ba(OH)2溶液 d 加入Na2CO3溶液 e 过滤
(2)向饱和食盐水中先通入NH3,后通入CO2,理由是______.在滤液a中通入NH3和加入精盐的目的是______.
(3)请在图1流程图中添加两条物料循环的路线.____
(4)图2装置中常用于实验室制备CO2的是__(填字母编号);用c装置制备NH3,烧瓶内可加入的试剂是___(填试剂名称).
(5)一种天然碱晶体成分是aNa2CO3•bNa2SO4•cH2O,利用下列提供的试剂,设计测定Na2CO3质量分数的实验方案.请把实验方案补充完整:
供选择的试剂:稀H2SO4、BaCl2溶液、稀氨水、碱石灰、Ba(OH)2溶液
①______.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
高三化学实验题中等难度题查看答案及解析
-
(18分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调
节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
①上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
②步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
________、________、 NaOH。
③步骤2中,判断加入BaCl2已过量的方法是________
________________________。
(2)为检验精盐纯度,需配制100 mL 0.5mol/L(精盐)溶液,右图是该
同学转移溶液的示意图,图中的错误是
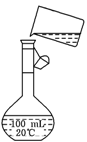
________________________________________________。
若在定容时仰视,则所配溶液的浓度_______0.5mol/L(填>或<)。
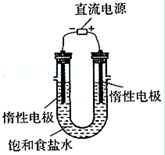
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,
则相同条件下收集的Cl2(填>、=或<)
2L,原因________
(4)某学习小组设计了如下图实验,将氯气依次通过下列装
置以验证氯气的性质:
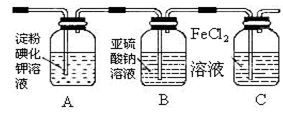
①通入氯气后,A中的现象是,整套实验装置存在的明显缺
陷是 。
②C装置中发生反应的离子方程式为。
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
________
高三化学实验题中等难度题查看答案及解析
-
我省盛产矿盐(主要成分是NaCl,还含有SO42-等其他可溶性杂质的离子).下列有关说法正确的是( )
A.由矿盐生产食盐,除去SO42-最合适的试剂是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐水中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液高三化学选择题中等难度题查看答案及解析
-
我省盛产矿盐(主要成分是NaCl,还含有SO42﹣等其他可溶性杂质的离子).下列有关说法正确的是
A.有矿盐生成食盐,除去SO42﹣ 最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
D.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
高三化学选择题中等难度题查看答案及解析
-
我省盛产矿盐(主要成分是NaCl,还含有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A.有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
高三化学单选题简单题查看答案及解析
-
(13分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质,不符合电解要求,因此必须经过精制.某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸
调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
________________.
(3)步骤2中,判断加入BaCl2已过量的方法是:_______________________________
_______________________.
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是
________________________________________________________________________.
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
同学转移溶液的示意图,图中的两处错误是:
________________________________________________
________________________________________________.
若在定容时仰视,则所配溶液的浓度_____________________________________
0.2 mol/L(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是: ________________________________________________________________________.
高三化学实验题中等难度题查看答案及解析