-
氯酸钾是常见的氧化剂,用于制造火药、烟火,工业上用石灰乳氯化法制备氯酸钾的流程如下所示:
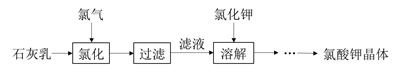
已知:氯化过程主要发生反应6Ca(OH)2 + 6Cl2 5CaCl2+Ca(ClO)2+6H2O
5CaCl2+Ca(ClO)2+6H2O
完成下列填空:
(1)工业生产氯气的方法是__________________。
(2)氯化过程需要控制较高温度,其目的有:
①_____________________________; ②减少 Cl2 与 Ca(OH)2 之间的副反应。
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应的化学方程式:__________________________________________________。
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是_________________。
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如下表:
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
①进行加热操作时,应将固体置于_________(填仪器名称)中。
②该实验不必进行第五次加热的原因是_______________________________________。
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况。
_______________________________________________________________
-
碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其它锰盐的原料,用于医药、电焊条辅助原料等。工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
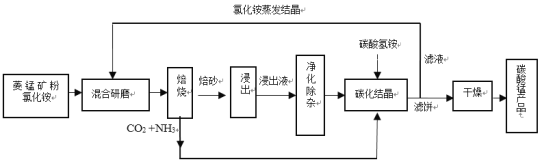
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子浓度c(Mn+)=0.1 mol• L -1,形成M(OH)n沉淀的pH范围如下:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 6.3 | 1.5 | 3.8 | 8.8 | 9.6 |
| 沉淀完全的pH | 8.3 | 2.8 | 5.2 | 10.8 | 11.6 |
③常温下,Ksp(CaF2) =1.46×10-10,Ksp(MgF2) = 7.30×10-11
回答下列问题:
(1)混合研磨成细粉的目的是_________________。
(2)“焙烧”时发生的主要反应的化学方程式为_____________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;再调节溶液pH范围为________将Al3+、Fe3+变为沉淀除去;再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol‧L-1时,c(Mg2+)=______mol‧L-1。
(4)碳化结晶过程中不能用(NH4)2CO3溶液代替NH4HCO3溶液可能的原因是_________。
(5)在操作流程中可以循环利用的物质是__________。
(6)测定碳酸锰产品的纯度。
称取0.2500g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至50 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2 )。重复操作3次,记录数据如下表:
)。重复操作3次,记录数据如下表:
| 滴定 次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) |
| 滴定前 | 滴定后 |
| 1 | 0.10 | 10.20 |
| 2 | 0.22 | 11.32 |
| 3 | 1.05 | 10.95 |
则产品的纯度=____________,若滴定终点时俯视读数,则测得的碳酸锰粗产品的纯度__________。(填“偏高”、“偏低”或“无影响”)。
-
磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:
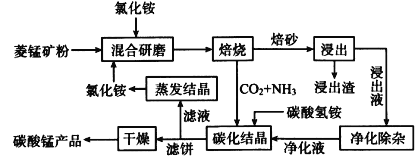
已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
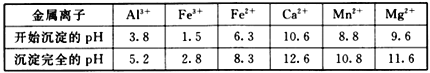
②相关金属Mn+离子c(Mn+) ═ 0.1 mol• L -1形成M(OH) n沉淀的pH范围如下:
③常温下,Ksp(CaF2) ═1.46×10-10 Ksp(MgF2) ═7.42×10-11 Ka(HF) ═1.00 ×10-4
回答下列问题:
(1)分析下列图1、图2,氯化铵焙烧锰矿粉的最佳条件是:__________________。
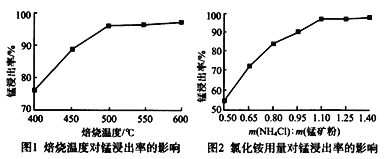
(2)“焙烧”时发生的主要反应的化学方程式为_________________________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为__________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去;然后加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液pH为6,c(Mg2+)═4.64×10-6 mol·L-1,c(HF)为_________mol·L-1。
(4)碳化结晶时,反应的离子方程式为_____________________________________。
(5)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________。
(6)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
| 滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) |
| 滴定前 | 滴定后 |
| 1 | 0.10 | 20.20 |
| 2 | 1.32 | 21.32 |
| 3 | 1.05 | 20.95 |
则产品的纯度=__________,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度___(填“偏高”“ 偏低”或“无影响”)。
-
磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol• L -1形成M(OH) n沉淀的pH范围如下:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
| 开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
| 沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_____________________________。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②调节溶液pH,将Al3+、Fe3+变为沉淀除去,调节pH范围为__________③加入NH4F将___________离子(填离子符号)沉淀除去。
(3)碳化结晶时,反应的离子方程式为_____________________________________。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是________________。流程中能循环利用的物质除了氯化铵之外还有____________。
(5)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
| 滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) |
| 滴定前 | 滴定后 |
| 1 | 0.10 | 20.20 |
| 2 | 1.32 | 21.32 |
| 3 | 1.05 | 20.95 |
则产品的纯度=__________,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_______(填“偏高”“ 偏低”或“无影响”)。
-
高锰酸钾常用作消毒剂、水质净化剂等。工业上用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)制备高锰酸钾晶体的一种工艺流程如下:
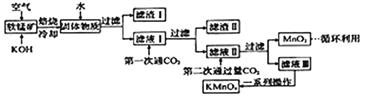
回答下列问题:
(1)焙烧过程中发生的主要反应为MnO2+ KOH+O2 K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀盐酸代替的原因是____________________________。
(3)第二次通入过 量 CO2生成 MnO2的离子方程式为__________________________。
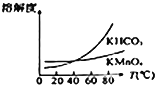
(4)由下图可知,从滤液Ⅲ得到高锰酸钾晶体需经过________、________、洗涤等一系列操作。
(5)1t含MnO287%的软锰矿,理论上最多可制得________tKMnO4晶体。
-
氯酸钾用途较广,用于炸药、高级安全火柴、氧化剂及火箭、导弹推进剂等。工业制备氯酸钾有以下两种方法
方法一:电解热的饱和食盐水可以制得到氯酸钠,再与一定量的氯化钾进行复分解反应,即可得到硫酸钾,流程图如下:
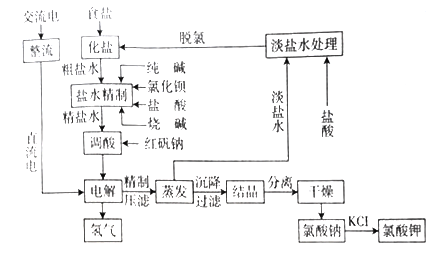
(1)①盐水精制时所加四种试剂是为了除去粗盐水中含有的_______等杂质离子,需将粗盐溶解后,按顺序加入药品进行沉淀、过滤等。加入药品的顺序可以是_______________。
②加入足量纯碱时,会有部分BaSO4转化成BaCO3。若l.0L BaSO4的悬浊液中含0.010 mol BaSO4固体,需加入_______摩尔Na2CO3才能将BaSO4完全转化为BaCO3。 (已知/Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.5×10-9)
(2)电解热饱和NaCl溶液的离子方程式为__________。 通电开始后,阴极附近溶液pH会________(填“增大”“减小”或“不变”)。
(3)过滤用到的三个玻璃仪器为________________________。
(4)过滤后滤液仍然浑浊的可能的操作原因:向漏斗中加液体时液面高于滤纸边缘;______________。
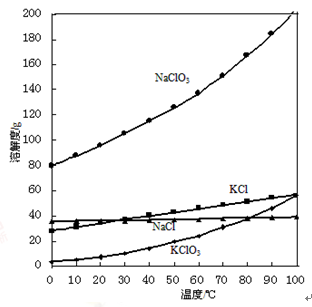
(5)将得到的氯酸钠与一定量的氯化钾进行复分解反应, KCl+NaC1O3 = KC1O3+NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。反应液经冷却至35℃以下时可析出氯酸钾晶体,原因是_______。在冷却降温析出KC1O3过程中,常伴有NaCl析出,分离出母液,将粗氯酸钾进行进一步提纯的方法是______________,操作步骤是蒸发浓缩、__________、过滤、洗涤、干燥,最后制得氯酸钾成品。
方法二:用热的石灰乳和氯气反应,再和氯化钾复分解反应制备:
(6)①C12转化为Ca(C1O3)2的化学方程式为_______________。
②提高Cl2转化为Ca(C1O3)2的转化率的可行措施有_________________。(填一条即可)
-
氯化亚铜 ,白色、易被氧化,
,白色、易被氧化, 广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉
广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉 主要含
主要含 、CuS、
、CuS、 、FeO等
、FeO等 制备活性CuCl的流程如下:
制备活性CuCl的流程如下:
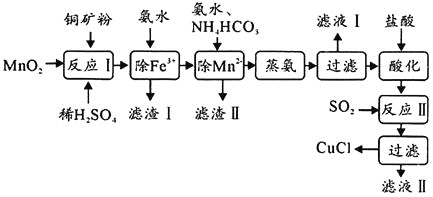
(1)滤渣Ⅰ是 和单质硫的混合物,反应Ⅰ中
和单质硫的混合物,反应Ⅰ中 参与反应的化学方程式为:
参与反应的化学方程式为: 未配平
未配平 ,氧化产物为________。
,氧化产物为________。
(2)除 时得
时得 沉淀,该反应的离子方程式为________。
沉淀,该反应的离子方程式为________。
(3)已知 可溶于氨水形成深蓝色溶液:
可溶于氨水形成深蓝色溶液: 。蒸氨条件及蒸氨效果见下表:
。蒸氨条件及蒸氨效果见下表:
| 序号 | 温度 | 时间 | 压强 | 残液颜色 |
| a | 110 | 60 | 
| 浅蓝色 |
| b | 100 | 40 | 
| 几乎很浅 |
| c | 90 | 30 | 
| 无色透明 |
由表中信息可知蒸氨的条件应选________ 填序号
填序号 。
。
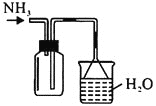
蒸出的氨气可以回收利用,在实验室用如图装置来收集。当集气瓶收集满氨气时观察到的现象是________。
(4)反应Ⅱ的离子方程式为________。
-
氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
(1)反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);滤渣Ⅰ成分是:__________。
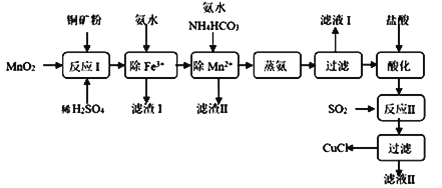
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为_________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。
Cu(OH)2+4NH3 [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
| 序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
| a | 110 | 60 | 101.3 | 浅蓝色 |
| b | 100 | 40 | 74.6 | 几乎很浅 |
| c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些不能支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
-
二水氯化钡晶体(BaCl2∙2H2O)在工业上主要用于制造各种钡盐、颜料和有机染料,某研究小组以重晶石(主要成分 BaSO4)制备BaCl2∙2H2O 流程如下图。
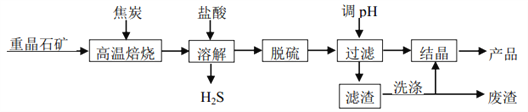
(1)已知:
① BaSO4(s)+ 4C(s)= 4CO(g) + BaS(s) △H1 = 571.2kJ•mol﹣1
② C(s)+ CO2(g)= 2CO(g) △H2 = 172.5 kJ•mol﹣1
反应 BaSO4(s)+ 2C(s)= 2CO2(g)+ BaS(s)的△H = _____ kJ•mol﹣1
(2)高温焙烧须加入过量的炭,同时还要通入空气,其目的是_____、_____。
(3)脱硫过程中分为两步, 第一步是物理脱硫, 第二步是化学脱硫。
① 物理脱硫是直接用蒸汽升温,并用空气“爆气法”除去的物质是_____。
② 下列物质不宜用作脱硫剂的是_____ (填字母)。
A. 高锰酸钾 B. 次氯酸钠 C. 双氧水 D.氯气
(4)上述流程中洗涤滤渣的主要目的是_____。
(5)溶解时产生的 H2S 可用 80~85 ℃时的石灰氮料浆(CaCN2的浆水混合物)吸收并制得更有价值的产品——硫脲[CS(NH2)2]和熟石灰。请写出制备硫脲的化学方程式_____。
-
氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:
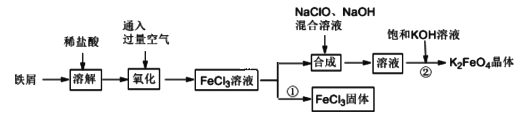
请回答下列问题:
(Ⅰ)(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为_______________________________。
(3)为了检验“氧化”过程中所得溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN 溶液 b.NaOH 溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液 e.酸性KMnO4溶液
(4)过程①制取FeCl3固体的具体操作步骤是_______________________。若使6.5 mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH 小于_________{已知该实验条件下,Ksp[(Fe(OH)3]=6.5×10-36,Kw=1.0×10-13(水离子积)}
(Ⅱ)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
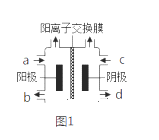
(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电解池总反应(化学方程式)__________________________________。

5CaCl2+Ca(ClO)2+6H2O















