-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是( )
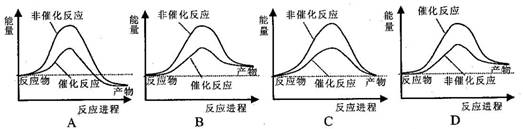
难度: 简单查看答案及解析
-
下列电离方程式书写正确的是( )
A.(NH4)2SO4
2NH4+ + SO42- B.H2CO3
2H+ + CO32-
C.H2SO4 =2H+ + SO42- D.NaHS=Na+ + H+ + S2-
难度: 简单查看答案及解析
-
在298K、100kPa时,已知:
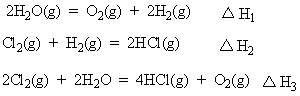
则⊿H3与⊿H1和⊿H2间的关系正确的是( )
A .△H3=△H1 + 2 △H2 B . △H3=△H1 + △H2
C. △H3=△H1 - 2 △H2 D. △H3=△H1 - △H2
难度: 简单查看答案及解析
-
某温度时,水的Kw=1.0×10-12。则在该温度时,PH=7的溶液( )
A.呈碱性 B. 呈中性 C. 呈酸性 D. 无法确定
难度: 简单查看答案及解析
-
在密闭容器中,一定条件下进行如下反应:
2NO(g) +2 CO(g)
N2(g) + 2CO2(g) ΔH= -746.4kJ·mol-1
达到平衡后,为提高反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B. 加催化剂同时增大压强
C.升高温度同时充入氮气 D.降低温度同时增大压强
难度: 简单查看答案及解析
-
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
难度: 简单查看答案及解析
-
电镀废液中Cr2O72—可通过下列反应转化成铬黄(PbCrO4):
Cr2O72—(aq)+2Pb2+(aq)+H2O(l)
2PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
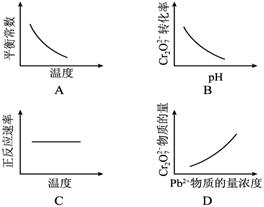
难度: 简单查看答案及解析
-
将浓度为0.1 mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是( )
A. c(H+) B. K(HF) C.
D.
难度: 简单查看答案及解析
-
将5.6g铁粉投入100mL2mol/L的稀硫酸中,2min时铁刚好完全溶解(忽略溶液体积变化)。下列有关这个反应的反应速率表示正确的是( )
A.铁的反应速率为0.5mol/(L·min) B.硫酸 的反应速率为0.5mol/(L·min)
C.硫酸亚铁的反应速率为0.5mol/(L·min)D. 氢气的反应速率为0.5mol/(L·min)
难度: 简单查看答案及解析
-
在25℃时,取PH均等于2的盐酸和醋酸溶液各100ml,先分别加水稀释至2 倍体积,再分别加入过量的锌粉。下列说法正确的是( )
A.醋酸与锌反应放出氢气多 B. 两种酸放出氢气一样多
C.醋酸与锌反应速率大 D.两种酸与锌反应的速率一样大
难度: 简单查看答案及解析
-
已知在等温等容条件下,有如下可逆反应:2A(g) + 2B(g)
3C(g) + D(g),现分别从两条途径建立平衡,途径Ⅰ:A、B的初始浓度均为2 mol/L;途径Ⅱ:C、D的初始浓度分别为6 mol/L和2 mol/L.下列叙述正确的是( )
A.Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的浓度相等
B. Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的体积分数相等
C. Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的反应速率相等
D. Ⅰ、Ⅱ途径分别达到平衡时,Ⅱ的气体密度是Ⅰ的两倍
难度: 简单查看答案及解析
-
已知一定温度下2X(g) + Y (g)
mZ(g) ΔH= -a kJ·mol-1 (a>0),现有甲乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2molX和1molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入1molX和0.5molY,达到平衡状态时,放出热量ckJ,且b>2c,则a、b、m的值或关系正确的是( )
A.m=4 B.a=b C.b<a D.m等于2或1
难度: 简单查看答案及解析