-
对于钠原子的第3层电子的p轨道3px、3py、3pz间的差异,下列几种说法中正确的是
A.电子云形状不同 B.原子轨道的对称类型不同
C.电子(基态)的能量不同 D.电子云空间伸展的方向不同
难度: 简单查看答案及解析
-
某物质熔融状态可导电,固态可导电,将其投入水中形成的水溶液也可导电,则可推测该物质可能是
A.金属 B.非金属 C.可溶性碱 D.可溶性盐
难度: 简单查看答案及解析
-
元素周期表中铋元素的数据见右图,下列说法正确的是
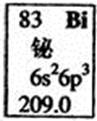
A.Bi元素的质子数是209
B.Bi元素的相对原子质量是209.0
C.Bi原子6p亚层有一个未成对电子
D.Bi原子最外层有5个能量相同的电子
难度: 简单查看答案及解析
-
下列有关化学键的叙述,正确的是
A.离子化合物中一定含有离子键 B.单质分子均不存在化学键
C.共价化合物一定只含有极性键 D.含有共价键的化合物一定是共价化合物
难度: 简单查看答案及解析
-
若M是ⅡA族的某元素,则与M同周期且相邻的元素不可能位于元素周期表的
A.ⅠA B.ⅠB C.ⅢA D.ⅢB
难度: 简单查看答案及解析
-
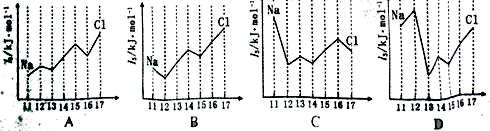
下列关于元素第一电离能的说法不正确的是
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必定依次增大
C.最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大
D.对于同一元素而言,原子的逐级电离能越来越大
难度: 简单查看答案及解析
-
下列元素电负性最大的是
A.最高正化合价和最低负化合价的代数和为4的短周期元素
B.最高正化合价与最低负化合价绝对值相等的元素
C.没有负化合价的元素
D.没有正化合价的元素
难度: 简单查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A.元素X的常见化合价是+1价
B.元素Y是IIIA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
难度: 简单查看答案及解析
-
溶液中同时存在Mg2+、Fe2+、Mn2+和Al3+四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据右表可知,下列说法错误的是
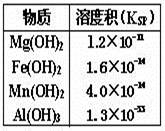
A.Al3+最先转化为Al(OH)3沉淀
B.加碱过程中,Fe2+、Mn2+几乎同时转化为沉淀
C.要使Mg2+转化为沉淀,溶液pH应大于9
D.pH=14时,四种金属离子全部以沉淀形式存在
难度: 简单查看答案及解析
-
实验室常用硫酸铜溶液吸收气体中的硫化氢:CuSO4+H2S=CuS↓+H2SO4,该反应可以推测
A.CuS易水解
B.CuS可溶于盐酸
C.相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大
D.强酸可以制取弱酸
难度: 简单查看答案及解析
-
下面的排序不正确的是
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al D.晶格能由大到小:NaF> NaCl> NaBr>NaI
难度: 简单查看答案及解析
-
下列物质中分子间能形成氢键的是
A.N2 B.HBr C.NH3 D.H2S
难度: 简单查看答案及解析
-
合金有许多特点,如Na—K合金为液体,而Na和K的单质均为固体。据此,试推测生铁、纯铁、碳三种物质中,熔点最低的是
A.纯铁 B.生铁(Fe、C的合金) C.碳 D.无法确定
难度: 简单查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能Y一定也小于X
C.最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性
D.气态氢化物的稳定性:HmY小于HmX
难度: 简单查看答案及解析
-
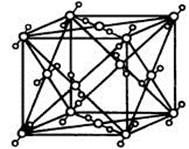
2001年报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录。图示意的是该化合物的晶胞结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱侧面上。则该化合物的化学式为
A.MgB B.Mg3B2 C.Mg2B D.Mg2B2
难度: 简单查看答案及解析
-
已知:为使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量Fe3+、Fe2+,为除去这些离子制得纯净的硫酸锌,应加入的试剂是
A.NaOH溶液 B.氨水 C.KMnO4、ZnCO3 D.H2O2、ZnO
难度: 简单查看答案及解析
-
下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的图象是
⑴ ⑵ ⑶ ⑷
A.图⑴和图⑶ B.图⑵和图⑶
C.只有图⑴ D.图⑴和图⑷
难度: 简单查看答案及解析
-
SF6是一种优良的气体绝缘材料,分子结构中只存在S—F键。发生反应的热化学方程式为:S(s)+ 3F2(g) = SF6(g) ΔH=" -1220" kJ/mol。已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F—F键需吸收的能量为160 kJ,则断裂1mol S—F键需吸收的能量为
A.330 kJ B.276.67 kJ
C.130 kJ D.76.67 kJ
难度: 简单查看答案及解析
-
下列说法正确的是
A.124gP4含有的P-P键的个数为6NA
B.12g石墨中含有的C-C键的个数为2NA
C.12g金刚石中含有的C-C键的个数为1.5NA
D.60gSiO2中含Si-O键的个数为2NA
难度: 简单查看答案及解析
-
下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是
①H2O ②NH3 ③Cl— ④CN— ⑤CO
A.①② B.①②③ C.①②④ D.①②③④⑤
难度: 简单查看答案及解析
-
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-====CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
难度: 简单查看答案及解析
-
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
难度: 简单查看答案及解析
-
元素周期律为人们寻找新材料提供了科学的途径。下列说法不正确的是
A、在IA族可以找到光电材料
B、在IIIA、IVA、VA族可以找到优良的半导体材料
C、在IB、IIB、IIIB族可以找到高温超导材料
D、在VIII族可以找到新型农药材料
难度: 简单查看答案及解析
-
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是

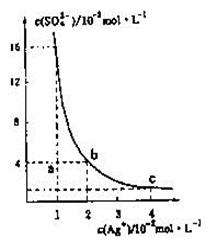
A.b点对应的Ksp等于c点对应的Ksp
B.采取蒸发溶剂的方法可以使溶液从a点变到b点
C.该温度下,Ag2SO4的溶度积常数(Ksp)为1.6×10-5(mol·L-1)3
D.0.02mol·L-1的AgNO3溶液与的0. 2mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
难度: 简单查看答案及解析


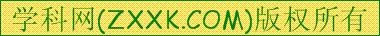 6
6