-
下列说法正确的是

A. 元素周期表中铋元素的数据见右图,Bi元素的质量数是209
B. H216O与H
O互为同素异形体
C. abXn-含有的电子数为a-n
D. 原子序数为29的元素位于元素周期表的第四周期ⅠB族
难度: 中等查看答案及解析
-
下列化学用语或命名正确的是
A. 次氯酸的结构式:H-Cl-O B. 含有10个中子的氧原子的符号:818O
C. S2-的结构示意图
 D. NH4Cl的电子式:
D. NH4Cl的电子式: 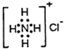
难度: 简单查看答案及解析
-
下列物质的颜色按“红、橙、黄、绿、蓝、紫”顺序排列的是
①CuSO4•5H2O ②AgI ③溴的四氯化碳溶液
④FeSO4•7H2O ⑤KMnO4溶液 ⑥碱性酚酞溶液
A. ⑥③②④①⑤ B. ⑤④③①②⑥ C. ⑥③①②④⑤ D. ②③①④⑤⑥
难度: 中等查看答案及解析
-
既能通过金属单质与足量Cl2反应得到,也能通过金属单质与酸反应得到的是
A. FeCl2 B. NaCl C. FeCl3 D. CuCl2
难度: 简单查看答案及解析
-
用下列方法测定空气中的污染物含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻愈小,它的电导愈大),如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围内的H2S,但电导变化不大;若用浓溴水吸收,仅限于低浓度范围内的H2S,但有很高的灵敏度。现要兼顾吸收容量与灵敏度,测定空气中Cl2的含量,则应选用下列吸收剂中的
A. Na2SO3溶液 B. KI溶液
C. NaOH溶液 D. H2O
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如下图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是
A.Y单质与氢气反应较Z剧烈
B.最高价氧化物对应水化物酸性W比Z强
C.X单质氧化性强于Y单质
D.X与W的原子核外电子数相差9
难度: 中等查看答案及解析
-
X、Y、Z、W、R属于短周期主族元素。X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m—n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。 下列叙述错误的是
A. X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B. Y的氢化物比R的氢化物稳定,熔沸点高
C. Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D. RY2、WY2通入Ba(NO3)2溶液中均无白色沉淀生成。
难度: 困难查看答案及解析
-
若已发现了116号元素则下列推断正确的是:①其钠盐的化学式为Na2R ②其最高价氧化物对应的水化物的酸性比硫酸强③R是金属元素④R是非金属元素⑤最外电子层有6个电子
A. ①②③ B. ①③⑤ C. ②④⑤ D. ③⑤
难度: 中等查看答案及解析
-
下列物质性质的变化规律,可用共价键的键能解释的是
A. N2比O2的化学性质稳定 B. F2、C12、Br2、I2的沸点逐渐升高
C. 氯化钠晶体的熔点很高 D. HF比HCl的沸点高
难度: 中等查看答案及解析
-
下列各组物质中,均含有共价键,却又都不属于共价化合物的一组
A. Na2O2 Na2O B. KClO NaOH
C. Br2 HBr D. HF H2O
难度: 中等查看答案及解析
-
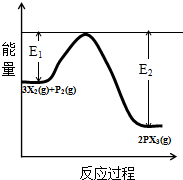
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是

A. P4S3中磷元素为+3价
B. P4S3属于共价化合物
C. P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2
D. 1mol P4S3分子中含有9mol共价键
难度: 困难查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸反应 B.灼热的木炭与CO2反应
C.乙醇在氧气中燃烧 D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
难度: 中等查看答案及解析
-
已知拆开1mol氢气中的化学键需要消耗436.4KJ能量,拆开1mol氧气中的化学键需要消耗498KJ能量,形成水分子中的1molH-O键能够释放462.8KJ能量,则反应2H2(g)+O2(g)=2H2O(g)的能量变化是
A. 吸收445.2KJ B. 吸收480.4KJ C. 放出445.2KJ D. 放出480.4KJ
难度: 简单查看答案及解析
-
下列叙述正确的是
A. HCl和NaOH反应的中和热为△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ/mol
B. CO(g)燃烧热△H=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+ 2×283.0
kJ/mol
C. 用等体积的0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液进行中和热测定的实验,会使测得的中和热偏大
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 困难查看答案及解析
-
下列图示关系不正确的是
A.
 B.
B. 
C.
 D.
D. 
难度: 简单查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.已知C(石墨, s)=C(金刚石, s) ΔH>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g) ΔH1 ;C(s)+1/2O2(g)=CO(g) ΔH2,则ΔH2>ΔH1
C.已知2H2(g)+O2(g)=2H2O(g) ΔH= -483.6 kJ/mol,则氢气的燃烧热为241.8kJ/mol
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol
难度: 中等查看答案及解析
-
金属冶炼一般有下列四种方法:①焦炭法 ②水煤气(或H2、CO)法 ③活泼金属置换法④电解法。这四种方法在工业上均有应用。古代有:(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析,不正确的是
A.(Ⅰ),① B.(Ⅱ),② C.(Ⅲ),③ D.(Ⅳ),④
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源。下图是从海水中提取某些原料的流程图。
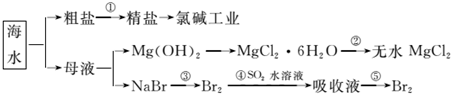
下列有关说法正确的是( )
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.工业上通过氯碱工业制取金属钠
C.从第③步到第⑤步的目的是浓缩、富集溴单质
D.第②步的反应条件是高温加热
难度: 简单查看答案及解析
-
下列从海水中提取镁的工艺流程中,你认为最合理的是
A. 海水
Mg(OH)2
Mg
B. 海水
Mg(OH)2
MgCl2
Mg
C. 海水
MgCl2
Mg
D. 海水
MgCl2
Mg
难度: 中等查看答案及解析
-
金属钾的冶炼可采用如下方法:2KF+CaC21237~1423CCaF2+2K↑+2C,下列有关说法合理是
A.该反应的氧化剂是KF,氧化产物是K
B.该反应能说明C的还原性大于K
C.电解KF溶液不可能制备金属钾
D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2∶1
难度: 中等查看答案及解析
-
已知:H2O(g)==H2O(l) △H1=-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)==C2H5OH(l) △H2=-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(g) △H3=-Q3kJ·mol-1(Q3>0)
依据盖斯定律,若使23g液态乙醇完全燃烧并恢复至室温,则放出的热量为(单位:kJ)
A. Q1+Q2+Q3 B. 0.5(Q1+Q2+Q3) C. 0.5Q1-1.5Q2+0.5Q3 D. 1.5Q1-0.5Q2+0.5Q3
难度: 中等查看答案及解析
-
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2
2Cl2+2H2O
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.

判断下列说法正确的是( )
A.反应A的△H>-115.6kJ·mol-1
B.H2O中H—O键比HCl中H—Cl键弱
C.由II中的数据判断氯元素的非金属性比氧元素强
D.断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
难度: 中等查看答案及解析
-
下列有关热化学方程式的评价合理的是
实验事实
热化学方程式
评价
A
已知H+(aq)+OH-(aq)=H2O(l)
△H=-57.3kJ•mol-1,将稀硫酸与稀氢氧化钡溶液混合
H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)
△H=-114.6kJ•mol-1
正确
B
稀醋酸与稀氢氧化钠溶液混合
CH3COOH(aq)+NaOH(aq)=NaCl(aq)+H2O(l)
△H=-57.3k J•mol-1
不正确;因为醋酸状态为“l”,而不是“aq”
C
160g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6kJ
SO3(g)+H2O(l)=H2SO4(aq)
△H=-130.3kJ•mol-1
不正确;因为反应热为△H=-260.6
kJ•mol-1
D
已知25℃、101kPa下,120g石墨完全燃烧放出热量3935.1kJ
C(s)+O2(g)=CO2(g)
△H=-393.51kJ•mol-1
不正确;同素异形体要注名称:C(石墨,S)
A. A B. B C. C D. D
难度: 困难查看答案及解析