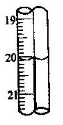
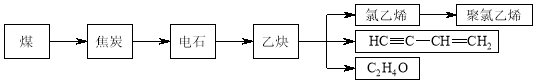
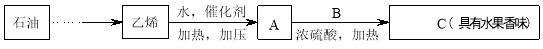-
3He月球上储量丰富,4He则来源于宇宙射线的初级粒子。下列关于3He和4He的说法正确的是
A.两者互为同位素 B.两者互为同素异形体
C.两者为同一种原子 D.两者具有相同的中子数
难度: 中等查看答案及解析
-
下列化学用语正确的是
A.HCl的电子式:
B.C-12原子: 12C
C.乙酸的结构简式:C2H4O2
D.NH3•H2O的电离方程式:NH3•H2O→NH4++OH-
难度: 中等查看答案及解析
-
某矿泉水标签上的部分内容为,钙≥4.0mg/L,钾≥0.35mg/L,镁≥0.5mg/L,钠≥0.8mg/L。标签中的钙、钾、镁、钠指的是
A.原子 B.单质 C.元素 D.分子
难度: 中等查看答案及解析
-
酸碱中和反应 NaOH(?)+ HCl(?)→NaCl(?)+ H2O(?)+57.6 kJ中,问号表示的状态正确的是
A. NaOH:固 B.盐酸:液 C.NaCl:溶液 D.H2O:溶液
难度: 中等查看答案及解析
-
相对原子质量原来以16O原子质量的十六分之一为标准,以该标准得到的仍为整数的是
A.14N的质量数 B.碳原子的相对质量
C.氯元素的相对原子质量 D.氢氧化钠的摩尔质量
难度: 中等查看答案及解析
-
以下有关物质用途的叙述错误的是
A.明矾:净水剂
B.四氯化碳:灭火剂
C.四氧化三铁:红色颜料
D.小苏打:治胃酸过多
难度: 中等查看答案及解析
-
第三周期主族元素中,原子半径最大的是
A. Na B.Si C.S D.Cl
难度: 中等查看答案及解析
-
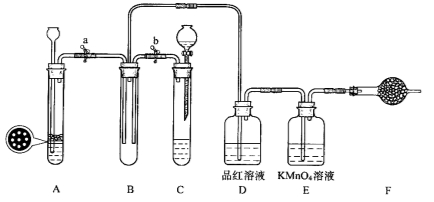
下图是产生和收集气体的实验装置,该装置不适合于

A.用锌和盐酸制取H2
B.用NH4Cl和Ca(OH)2制取NH3
C.用电石和饱和食盐水制取C2H2
D.用H2O2在MnO2催化下制O2
难度: 中等查看答案及解析
-
铝制餐具使用广泛,铝在空气中稳定存在的原因是
A.能发生铝热反应 B.铝的化学性质不活泼
C.常温下铝不与氧气反应 D.铝表面能形成致密的氧化膜
难度: 简单查看答案及解析
-
某同学查阅资料得知制作皮蛋的料泥中含有NaOH和Na2CO3,将料泥溶解过滤后,向滤液中加入以下试剂,肯定不会出现的现象是
A.酚酞—溶液变红 B.石蕊—溶液变蓝
C.甲基橙—溶液变黄 D.滴加稀盐酸—立即产生气体
难度: 简单查看答案及解析
-
下列物质既含有离子键又含有共价键的是
A.H2O B.Na2O C.NH4Cl D.N2
难度: 简单查看答案及解析
-
能用离子方程式Ba2++SO42- →BaSO4↓表示的是
A.氯化钡和硫酸钠溶液反应 B. 碳酸钡和稀硫酸反应
C.氢氧化钡和硫酸铝溶液反应 D. 氢氧化钡和稀硫酸反应
难度: 简单查看答案及解析
-
下列各组离子在溶液中可以大量共存的是
A.Ba2+、NO3-、OH- B.H+、K+、CO32-
C.Cu2+、S2-、Cl- D.Fe3+、Na+、SCN-
难度: 简单查看答案及解析
-
下图所示装置中不存在的仪器是
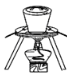
A.坩埚 B.泥三角 C.三脚架 D.石棉网
难度: 简单查看答案及解析
-
下列有机反应表达错误的是
A.CH4+Cl2
CH3Cl+HCl B.2CH3CH2OH +2Na→2CH3CH2ONa+H2↑
C.
D.
难度: 中等查看答案及解析
-
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可表示为:2Li + I2 → 2LiI。下列有关说法错误的是
A.放电时化学能转化为电能 B.负极反应为:Li –e→Li+
C.正极反应为:I2+2e →2I- D.电子由正极流向负极
难度: 简单查看答案及解析
-
常温下,将0.1mol/L的醋酸和0.1mol/L的NaOH溶液等体积混合,所得溶液中不存在的关系是
A.c(OH-)>c(H+)
B.c(CH3COOH)>c(CH3COO-)
C.c(Na+)>c(CH3COO-)
D.c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)
难度: 简单查看答案及解析
-
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
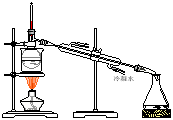
A.海带灼烧成灰 B.过滤得含I-溶液 C.放出碘的苯溶液 D.分离碘并回收苯
难度: 简单查看答案及解析
-
在真空密闭装置中,亚氯酸钠(NaClO2)固体在一定条件下发生分解反应,从物质组成的角度看,不可能生成的产物是
A.NaCl和O2 B.NaClO3和NaClO
C.NaClO3和Cl2 D.NaClO3和NaCl
难度: 简单查看答案及解析
-
将0.1mol镁铝合金(Mg17Al12)完全溶解于1.2 L 6mol/L的盐酸中,为使反应后溶液中的Mg2+、Al3+完全沉淀,需加入10 mol/L的氨水至少
A.0.56L B.0.70 L C.0.72L D.0.84 L
难度: 中等查看答案及解析