-
下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是( )
A. K、Na、Li B. Al、Mg、Na
C. N、O、C D. Cl、S、P
难度: 中等查看答案及解析
-
下列表示钠原子的符号和图示中能反映能级差别和电子自旋状态的是( )
A.
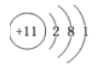 B.
B. C.
D.
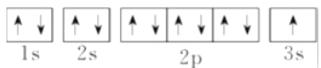
难度: 中等查看答案及解析
-
在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A. 最易失去的电子一般能量最高
B. 电离能最小的电子能量最高
C. p轨道电子能量一定高于s轨道电子能量
D. 在离核最近区域内运动的电子能量最低
难度: 简单查看答案及解析
-
下列现象和应用与电子跃迁无关的是( )
A. 激光 B. 焰色反应 C. 原子光谱 D. 燃烧放热
难度: 简单查看答案及解析
-
已知某元素的+2价离子的电子排布式为1s22s22p63s23p6,则该元素在周期表中属于( )
A. 第3周期ⅤB族 B. 第4周期ⅡB族
C. 第4周期Ⅷ族 D. 第4周期ⅡA族
难度: 简单查看答案及解析
-
下列说法正确的是( )
①电子云中的一个小黑点代表一个电子 ② 电子云密度大的地方,说明电子在核外空间单位时间内出 现的机会多 ③ 原子轨道是指原子运行的轨道 ④s 电子的电子云呈球形,p 电子的电子云呈哑铃形
A. ①② B. ②③ C. ③④ D. ②④
难度: 中等查看答案及解析
-
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
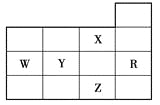
A. W元素的第一电离能小于Y元素的第一电离能
B. Y、Z的阴离子电子层结构都与R原子的相同
C. p能级未成对电子最多的是Z元素
D. X元素是电负性最大的元素
难度: 简单查看答案及解析
-
下列说法错误的是( )
A. ns 电子的能量不一定高于(n-1)p 电子的能量
B. 如果 6C 的电子排布式为 1s22s22px2 ,则违反了洪特规则
C. 如果 21Sc 电子排布式为 1s22s22p63s23p63d3,则违反了能量最低原理
D. 如果 22Ti 电子排布式为 1s22s22p63s23p10,则违反了泡利原理
难度: 中等查看答案及解析
-
X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( )
A. Y原子的价层电子排布式为3s23p5 B. 稳定性:Y的氢化物>Z的氢化物
C. 第一电离能:Y<Z D. X、Y两元素形成的化合物为离子化合物
难度: 简单查看答案及解析
-
ⅣA、ⅤA、ⅥA、ⅦA 四个主族元素的氢化物的沸点变化趋势如下图所示,分析图中的递变规律,下列结论中正确的是( )
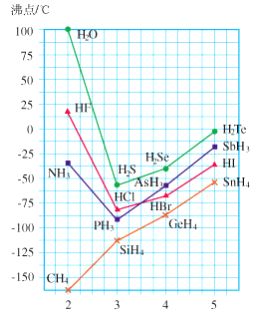
A. CH4 分子间的氢键较弱,故其沸点较低
B. 图中的横坐标的数值表示的是中心原子的主族序数
C. ⅣA 族元素氢化物的稳定性随相对分子质量的递增逐渐增强
D. H2O、HF、NH3 三种物质的沸点比同主族的其他氢化物都高,是因 为组成这三种物质的分子间均可形成氢键
难度: 中等查看答案及解析
-
下列分子中所有原子都满足最外层为8电子结构的是
A. BF3 B. H2O C. SiCl4 D. PCl5
难度: 中等查看答案及解析
-
下列关于物质性质的递变规律正确的是( )
A. 沸点:F2>Cl2>Br2>I2
B. 稳定性:HF>H2O>NH3>CH4
C. 酸性:HClO>HClO2> HClO3> HClO4
D. 离子半径:Al3+> Mg2+> Na+
难度: 中等查看答案及解析
-
下列关于丙烯(CH3﹣CH═CH2)的说法中正确的( )
A. 丙烯分子中有 6 个 σ 键,1 个 π 键
B. 丙烯分子中 3 个碳原子都是 sp3 杂化
C. 丙烯分子属于极性分子
D. 丙烯分子中 3 个碳原子在同一直线上
难度: 中等查看答案及解析
-
最近,中国科大的科学家们将 C60 分子组装在一单层分子膜表面,在-268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定 既含单键又含双键的是( )
A. CO2 B. SO3 C. COCl2 D. H2O2
难度: 中等查看答案及解析
-
374℃、22.1MPa 以上的超临界水具有很强的溶解有机物的能力,并含有较多的 H+和 OH―,由此可知超临界水( )
A. 显中性,pH 等于 7
B. 表现出非极性溶剂的特性
C. 显酸性,pH 小于 7
D. 表现出极性溶剂的特性
难度: 中等查看答案及解析
-
X、Y、Z 是三种短周期元素,其中 X、Y 位于同一主族,Y、Z 处于同一周期,X 原子的最外层电子排布式是 2s22p4,Z 原子的核外电子数比 Y 原子少 1。下列说法不正确的是( )
A. CX2(C 是原子核内含 6 个质子的元素)分子是非极性分子
B. ZH3 的 VSEPR 模型名称为三角锥形
C. Z4 分子是非极性分子
D. 酸 H2YO4 比酸 H3ZO4 的酸性强
难度: 中等查看答案及解析
-
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点 A2D<A2X
B. CA3 分子是非极性分子
C. B、C、D 形成的气态氢化物互为等电子体
D. C 形成的常见单质中 σ 键与 π 键个数之比为 1:2
难度: 中等查看答案及解析
-
下列对分子性质的解释中,不正确的是
A. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键
B. 乳酸有一对对映异构体,因为其分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
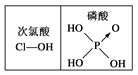
难度: 中等查看答案及解析
-
某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是 ( )
A. 配合物中中心原子的电荷数和配位数均为6
B. 该配合物可能是平面正方形结构
C. Cl-和NH3分子均与Pt4+配位
D. 配合物中Cl-与Pt4+配位,而NH3分子不配位
难度: 中等查看答案及解析
-
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是
A. X元素的氢化物的水溶液显碱性
B. Z元素的离子半径大于W元素的离子半径
C. Z元素的单质在一定条件下能与X元素的单质反应
D. Y元素最高价氧化物的晶体具有很高的熔点和沸点
难度: 困难查看答案及解析