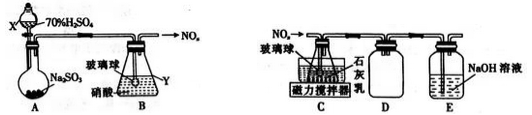
-
下列离子组在一定条件下能大量共存,且加入相应试剂后所对应的离子方程式正确的是
选项
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
Fe2+、NO3-、K+
稀硫酸
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
B
Fe3+、I-、ClO-
氢氧化钠溶液
Fe3++3OH-=Fe(OH)3↓
C
Ba2+、HCO3-、Cl-
氢氧化钠溶液
HCO3-+ OH-=CO32-+H2O
D
Al3+、Cl-、NO3-
过量氢氧化钠液
Al3++3OH-=Al(OH)3↓
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列有关安全生产的做法不正确的是
A. 面粉生产车间应严禁烟火
B. NH3泄露时向空中喷洒水雾
C. 含Cl2的尾气用碱溶液处理后再排放
D. 金属钠失火时应立即用大量冷水扑火
难度: 简单查看答案及解析
-
X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法错误的是

A. 简单离子半径:Y < W
B. 最高价氧化物对应水化物的酸性:Z < W
C. R为氧元素
D. X与Z可以形成正四面体结构的分子
难度: 中等查看答案及解析
-
下列设计的实验方案能达到相应实验目的的是( )
选项
实验目的
实验方案
A
证明“84”消毒液的氧化能力随溶液pH的减小而增强
将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色
B
证明反应速率会随反应物浓度的增大而加快
用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L﹣1CuSO4溶液,迅速产生较多气泡
C
检验淀粉是否水解
在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸
D
证明SO2有漂白性
将SO2通入酸性高锰酸钾溶液中
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
25 ℃时,向盛有50 mL pH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是
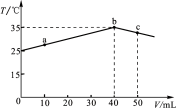
A. a→b的过程中,溶液中c(A-)与c(HA)之和始终不变
B. c点表示酸碱恰好完全反应
C. 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+)
D. 25 ℃时,HA的电离平衡常数Ka约为1.43×10-3
难度: 困难查看答案及解析
-
一种碳纳米管新型二次电池的装置如图所示。下列说法中正确的是

A. 离子交换膜选用阳离子交换膜(只允许阳离子通过) B. 正极的电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
C. 导线中通过1mol电子时,理论上负极区溶液质量增加1g D. 充电时,碳电极与电源的正极相连
难度: 困难查看答案及解析




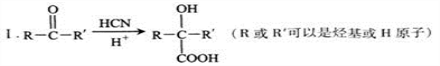
 的说法正确的是_________________。
的说法正确的是_________________。