-
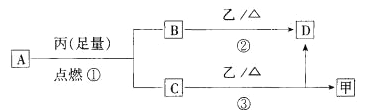
A、B、C、D、E五种短周期元素的原子序数逐渐增大。A是原子半径最小的元素,B可形成多种同素异形体,其中一种的硬度是自然界中最大的。D元素原子的最外层电子数是次外层电子数的3倍。E元素的M层电子数等于A和B的质子数之和。
(1)写出元素D在元素周期表中的位置:________________________。
(2)B、C、D三种元素的最简单氢化物的稳定性由强到弱的顺序是________________(填化学式)。
(3)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间发生反应的一个离子方程式:________________________________。
(4)ED2是一种具有强氧化性的新型消毒剂,一定条件下4mol ED2与5 mol C2A4恰好完全反应,请写出反应的化学方程式:_________________________________;若反应消耗1 mol C2A4,则转移电子的物质的量为______________。
-
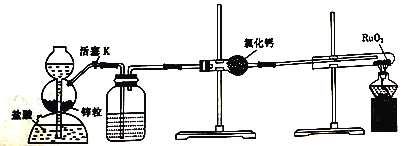
锰及其化合物在现代工业及国防建设中具有十分重要的意义。回答下列问题:
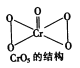
(1)常用铝热法还原软锰矿(主要成分为MnO2)来制金属锰。因为铝和软锰矿反应剧烈,所以先在强热条件下将软锰矿变为Mn3O4,然后再将其与铝粉混合。
①MnO2中Mn的化合价为________________。
②铝粉与Mn3O4反应时,还原剂与氧化剂的物质的量之比为_________________。
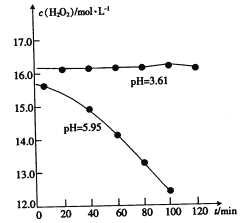
(2)pH=0的溶液中,不同价态锰的微粒的能量(△G)如图所示,若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO)能量连线的上方,则该微粒不稳定,会发生歧化反应,转化为相邻价态的微粒。
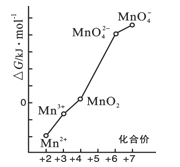
①MnO42-_________________(填“能”或“不能”)稳定存在于pH=0的溶液中。
②实验室可利用以下反应检验Mn2+的存在:2Mn2++5S2O82-+8H2O=16H++10SO42-+2MnO4-,确认Mn2+存在的现象是__________________;检验时必须控制Mn2+的浓度和用量,否则实验失败。理由是___________________________________。
-
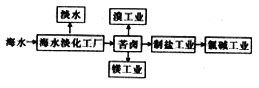
CeO2是一种重要的稀土氧化物,可利用氟碳铈矿(主要成分为CeFCO3)来制备。其工艺流程如下:
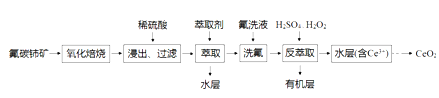
已知:I.Ce4+能与SO42-结合成[CeSO4]2+,与F-结合成[CeFx](4-x)+(0<x<4).
II.在硫酸体系中,Ce4+能被萃取剂萃取二Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是_________________。
(2)CeO2不溶于水和碱,微溶于酸,但“浸出”时却能溶解完全,原因是溶液中的_______(填原子符号,下同)、__________、_____________促进了CeO2的溶解。
(3)“反萃取”时发生反应的离子方程式为____________________。
(4)若缺少“洗氟”这一环节,则所得产品的质量将___________(填“偏大”“偏小”或“不变”)。
-
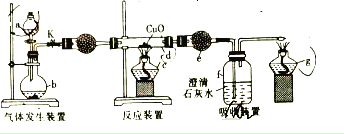
NOx、SO2是主要的大气污染物,能引发雾霾、光化学烟雾及酸雨。
(1)NO2会产生硝酸型酸雨,硝酸型酸雨中主要溶质的化学式为_______________。
(2)目前新出厂的汽车均加装尿素[CO(NH2)2]箱,尾气中NO、NO2及尿素以物质的量之比1:1:1加热催化生成无害气体的化学方程式为_____________________________。
(3)氨化法同时脱硫脱硝的原理如下(已知NH4NO2在浓度较大时会分解)
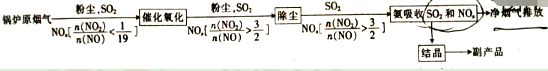
①“催化氧化”的目的是________________。
②最终得到副产品的主要成分为____________(填化学式)。
③相同条件下用氨水作吸收剂,NOx的脱除率与pH及 的关系如图所示。
的关系如图所示。
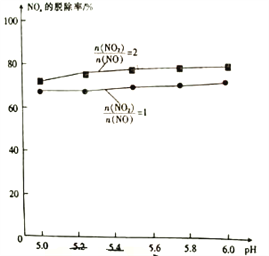
pH及其他条件相同时,  的比值越大,NOx的拖出率也越大,其主要原因是_________________。
的比值越大,NOx的拖出率也越大,其主要原因是_________________。