-
锰及其化合物在现代工业及国防建设中具有十分重要的意义。回答下列问题:
(1)常用铝热法还原软锰矿(主要成分为MnO2)来制金属锰。因为铝和软锰矿反应剧烈,所以先在强热条件下将软锰矿变为Mn3O4,然后再将其与铝粉混合。
①MnO2中Mn的化合价为________________。
②铝粉与Mn3O4反应时,还原剂与氧化剂的物质的量之比为_________________。
(2)pH=0的溶液中,不同价态锰的微粒的能量(△G)如图所示,若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO)能量连线的上方,则该微粒不稳定,会发生歧化反应,转化为相邻价态的微粒。
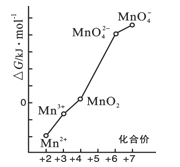
①MnO42-_________________(填“能”或“不能”)稳定存在于pH=0的溶液中。
②实验室可利用以下反应检验Mn2+的存在:2Mn2++5S2O82-+8H2O=16H++10SO42-+2MnO4-,确认Mn2+存在的现象是__________________;检验时必须控制Mn2+的浓度和用量,否则实验失败。理由是___________________________________。
-
锰及其化合物在现代工业及国防建设中具有十分重要的意义。回答下列问题:
(1)常用铝热法还原软锰矿(主要成分为MnO2)来制金属锰。因为铝与软锰矿反应剧烈,所以先在强热条件下将软锰矿转变为Mn3O4,然后再将其与铝粉混合。
①MnO2中Mn的化合价为____________________。
②铝粉与Mn3O4反应时,还原剂与氧化剂的物质的量之比为_________________。
(2)pH=0的溶液中,不同价态锰的微粒的能量(E)如图所示。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线的上方,则该该微粒不稳定,会发生歧化反应,转化为相邻价态的微粒。
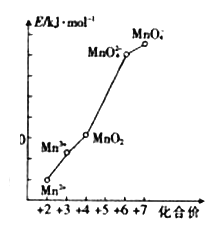
①MnO42-______(填“能”或“不能”)稳定存在于pH=0的溶液中。
②实验室可利用以下反应检验Mn2+的存在:2Mn2++5S2O82-+8H2O==16H++10SO42-+2 MnO42-,确认Mn2+存在的现象是______________________;检验时必须控制Mn2+的浓度和用量,否则实验失败,理由是___________________________________。
-
锰及其化合物在现代工业和国防建设中具有十分重要的地位。金属锰的提炼方式主要有热还原法和电解法两种,热还原法得到的锰纯度在95-98%之间,电解法得到的锰(简称电解锰),其纯度可达99.7-99.9%以上。
(1)锰锌铁氧体是当前广泛使用的一种隐形涂料,其化学组成为MnxZn1-xFe2O4(铁为+3价),其中当锰锌铁氧体中n(Zn):n(Fe)=2:5时,它对雷达波的吸收能力最强。
① 锰锌铁氧体中锰元素的化合价为_______。
② 当雷达波吸收能力最强时,该物质的化学式为________(改写成氧化物的形式)。
(2)写出以MnO2和Al粉为原料,利用热还原法制备Mn的化学方程式:________.
(3)工业上以菱锰矿(主要成分是MnCO3,含有Fe2+、Co2+、Ni2+等杂质金属离子)为原料制备电解锰的流程图如下所示。
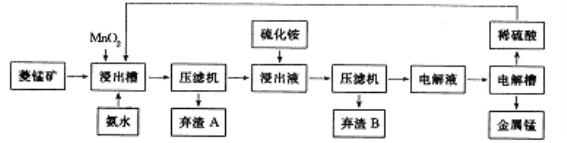
生成氢氧化物的pH如下表:
| 物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀时pH | 7.5 | 2.l | 7.7 | 7.6 | 8.3 |
| 完全沉淀时pH | 9.7 | 3.7 | 8.5 | 8.2 | 9.8 |
① 浸出槽中发生多个反应:如主要成分与硫酸的反应、MnO2与Fe2+间的氧化还原反应等,写出这两个反应的离子方程式:___________________、____________________。
② 加入氨水的目的是为除去杂质,根据流程图及表中数据,pH 应调控在_____范围内。常温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=4时溶液中c(Fe3+)=__________。
③ 加入硫化铵是为除去剩余的Ni2+,反应的离子方程式为____________________。
④ 写出电解硫酸锰溶液制取金属锰的化学方程式:________________________。
-
锰及其化合物在现代工业和国防建设中具有十分重要的地位。金属锰的提炼方式主要有热还原法和电解法两种,热还原法得到的锰纯度在95-98%之间,电解法得到的锰(简称电解锰),其纯度可达99.7-99.9%以上。
(l)锰锌铁氧体是当前广泛使用的一种隐形涂料,其化学组成为MnxZn1-xFe2O4(铁为+3价),其中当锰锌铁氧体中n(Zn):n(Fe)=2:5时,它对雷达波的吸收能力最强。
① 锰锌铁氧体中锰元素的化合价为_______。
② 当雷达波吸收能力最强时,该物质的化学式为________(改写成氧化物的形式)。
(2)写出以MnO2和Al粉为原料,利用热还原法制备Mn的化学方程式:________.
(3)工业上以菱锰矿(主要成分是MnCO3,含有Fe2+、Co2+、Ni2+等杂质金属离子)为原料制备电解锰的流程图如下所示。
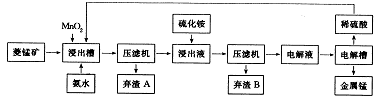
生成氢氧化物的pH如下表:
| 物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀时pH | 7.5 | 2.l | 7.7 | 7.6 | 8.3 |
| 完全沉淀时pH | 9.7 | 3.7 | 8.5 | 8.2 | 9.8 |
① 浸出槽中发生多个反应:如主要成分与硫酸的反应、MnO2与Fe3+间的氧化还原反应等,写出这两个反应的离子方程式:______
② 加入氨水的目的是为除去杂质,根据流程图及表中数据,pH 应调控在_____范围内。常温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=4时溶液中c(Fe3+)=__________。
③ 加入硫化铵是为除去剩余的Ni2+,反应的离子方程式为_________。
④ 写出电解硫酸锰溶液制取金属锰的化学方程式:__________。
-
[化学——选修2:化学与技术]
高锰酸钾( )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
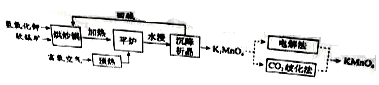
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“ 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
,阴极逸出的气体是 。
③“电解法”和“ 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L−1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
-
[化学——选修2:化学与技术]高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“ 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成K2MnO4、MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成K2MnO4、MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③“电解法”和“ 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L−1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为 (列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
-
高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
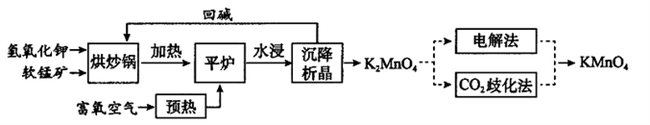
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是_________________。
(2)“平炉”中发生的化学方程式为_________________,该条件下此反应的△S____0(填大于、小于或等于)。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应生成的含锰物质有KMnO4和MnO2,该反应的化学方程式为__________________。
②“电解法”为现代工艺,即电解K2MnO4水溶液,若用惰性电极,阳离子交换膜电解槽电解时产品纯度高,阴极室中加入电解质溶液溶质的化学式为_______,电解时阳极发生的电极反应为____________,从阳极室的溶液得到产品的实验操作是___________________。与传统工艺比较,现代工艺的优点除产品纯度高外还有_______________。
-
高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
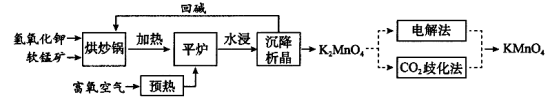
回答下列问题:
(1)“平炉”中发生的化学方程式为 。
(2)“平炉”中需要加压,其目的是 。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③CO2的等电子体COS,分子 COS电子式为_____________。
(4)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L−1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液滴定,滴定终点现象 ,该反应中,氧化剂与还原剂的物质的量之比 。
-
高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
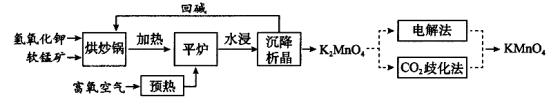
回答下列问题:
(1)“平炉”中发生的化学方程式为 。
(2)“平炉”中需要加压,其目的是 。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③CO2的等电子体COS,分子 COS电子式为_______________。
(4)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L−1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液滴定,滴定终点现象 ,该反应中,氧化剂与还原剂的物质的量之比为________________。
-
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质。工业上利用软锰矿制取碳酸锰(MnCO3)流程如下:
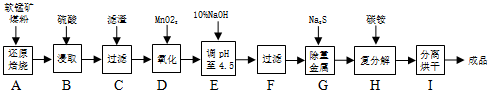
其中,还原焙烧主反应为:2MnO2+C=2MnO+CO2↑。根据要求回答问题:
(1)步骤D中Fe2+被氧化,该反应的离子方程式为 。
(2)步骤H的离子方程式为 。
(3)加入Na2S可以除去Pb2+、Al3+等离子。已知Ksp(PbS)=1×10-28 Ksp(MnS)= 1×10-9.6 ,当溶液中c(Pb2+)=1×10-5mol·L-1时,溶液中c(Mn2+)允许的最大值为 。
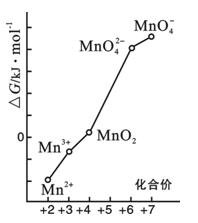
(4)pH=0的溶液中,不同价态锰的微粒的能量(△G)如右图。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒。
①MnO42—能否稳定存在于pH=0的溶液中?答:______________(“能”或“不能”);
②将Mn3+歧化反应设计为原电池,可测定反应平衡常数。电池负极反应为 ,平衡常数表达式为 ;
③实验室可利用以下反应检验Mn2+存在:2Mn2+ + 5S2O82- + 8H2O → 16H+ + 10SO42- + 2MnO4-
确认Mn2+存在的现象是 ;检验时必须控制Mn2+浓度和用量不能过大,否则实验失败。理由是 。










