-
某学生运用所学知识研究钠的性质:将一粒金属钠和一块铜片分别盛在表面皿中,来研究它们在空气中的稳定性。该学生采用的研究方法是:( )
①假说法 ②实验法 ③分类法 ④比较法
A.①② B.①③ C.②④ D.①③
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法不正确的是( )
A.2g氢气所含分子数目为NA
B.在标准状况下,NA个水分子所占有的体积约为22.4 L
C.18g水中含有的电子数为10NA
D.2.4g金属镁变为镁离子时失去的电子数为0.2 NA
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. 凡在溶液中能电离出H+的化合物都属于酸
B. 酸性氧化物一定能和碱溶液反应生成盐和水
C. 化合物一定是电解质
D. 纯碱属于碱类
难度: 简单查看答案及解析
-
实验室保存下列物质的方法中,不正确的是( )
A.少量金属钠保存在煤油里
B.液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封
C.为防止氧化,FeSO4溶液存放在加有少量铜粉的试剂瓶中
D.硝酸应装在棕色瓶中密封避光保存
难度: 简单查看答案及解析
-
下列叙述中,正确的是 ( )
A.H2SO4的摩尔质量是98
B.等质量的O2和O3中所含的氧原子数相同
C.等质量的CO与CO2中所含碳原子数之比为7︰11
D.98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol• L-1
难度: 简单查看答案及解析
-
下列溶液中Cl- 物质的量浓度最大的是( )
A.10mL0.1 mol·L-1的AlCl3溶液
B.20mL0.1 mol·L-1的CaCl2溶液
C.30mL0.2 mol·L-1的KCl溶液
D.100mL0.25 mol·L-1的NaCl溶液
难度: 简单查看答案及解析
-
把一小粒金属钠放入足量的硫酸铜溶液中。下列物质中属于该反应最终产物的是( )
A.Cu B.NaOH C.CuO D.Cu(OH)2
难度: 简单查看答案及解析
-
分类法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是( )
①根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔现象将分散系分为溶液、胶体和浊液
④根据水溶液是否能够导电将化合物分为电解质和非电解质
A.② B. ①③ C.②③ D. ②③④
难度: 简单查看答案及解析
-
以下说法正确的是( )
A.物质所含元素化合价升高的反应叫还原反应
B.在氧化还原反应中,失去电子的元素化合价降低
C.某元素由化合态变为游离态,则它一定被还原
D.置换反应一定属于氧化还原反应
难度: 简单查看答案及解析
-
下列反应的离子方程式书写中,正确的是 ( )
A. 硫酸与氢氧化钡在溶液中反应 Ba2++SO42-= BaSO4↓
B. 用Cl2将苦卤中的Br—氧化 Cl2 + Br— = Cl- + Br2
C. 用小苏打治疗胃酸过多 HCO3-+H+=CO2↑+H2O
D. 用FeCl3溶液腐蚀铜箔制造印刷电路板 Fe3++Cu=Fe2++Cu2+
难度: 简单查看答案及解析
-
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因可能是:
A.所用NaOH已潮解
B.向容量瓶加水时液面低于刻度线即摇匀
C.有少量NaOH溶液残留在烧杯内
D.向容量瓶加水时眼睛一直仰视液面
难度: 简单查看答案及解析
-
下列说法中正确的是 ( )
A. 用铁与稀硝酸反应来制备氢气
B. SO2能使湿润的蓝色石蕊试纸先变红后退色
C.NO2 溶于水发生了氧化还原反应,它既是氧化剂又是还原剂
D.钠在氧气中燃烧发出白光,生成白色固体氧化钠
难度: 简单查看答案及解析
-
下列各组离子中,能在溶液中大量共存的是( )
A. Na+、Cu2+、Cl-、OH- B. H+ 、Ca2+、HCO3-、NO3-
C.Ba2+、H+、SO42-、NO3- D. Na+、CO32-、OH-、K+
难度: 简单查看答案及解析
-
下列关于Na2CO3和NaHCO3的叙述中错误的是( )
A.等质量的两种盐分别与足量的盐酸反应,在相同情况下,NaHCO3产生的二氧化碳多
B.等物质的量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同情况下产生的二氧化碳体积相等
C.等物质的量的Na2CO3和NaHCO3分别与同浓度的盐酸反应,Na2CO3消耗盐酸的体积是NaHCO3消耗盐酸体积的2倍
D.将石灰水加入NaHCO3溶液中不产生白色沉淀,而加入Na2CO3溶液中则产生白色沉淀
难度: 简单查看答案及解析
-
向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
A.小于0.45摩 B.等于0.45摩
C.在0.45摩与0.90摩之间 D.大于0.90摩
难度: 简单查看答案及解析
-
在标准状况下,2.24L NOx气体的质量为4.6g则x值为 ( )
A.4 B.3 C.2 D.1
难度: 简单查看答案及解析
-
下列反应中,硫酸既表现了氧化性还表现了酸性的反应是( )
A.2H2SO4(浓)+Cu
CuSO4+2H2O+SO2↑
B.2H2SO4(浓)+C
CO2↑+2H2O+2SO2↑
C.H2SO4(浓)+NaCl
NaHSO4+HCl↑
D.H2SO4+Na2SO3
Na2SO4+H2O+SO2↑
难度: 简单查看答案及解析
-
含碘食盐中的碘是以碘酸钾(KIO3)形式存在的。已知在酸性溶液中IO3-和I-发生下列反应IO3-+5I-+6H+=3I2+3H2O。现有下列物质①稀硫酸;②pH试纸;③淀粉碘化钾溶液;④淀粉溶液。利用上述反应,可用来检验含碘食盐中含有IO3-的是( )
A、②④ B、①③ C、②③ D、①④
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A.氯气、液氯和氯水是同一种物质
B.工业上用H2和N2合成氨与自然界中放电时O2和N2反应都属于氮的固定
C.从海水中提取溴,一般要经历浓缩、氧化和提取三个步骤,氧化剂一般选择氯气
D.向盛有碘水的试管中加入适量CCl4,震荡静置,溶液分层,上层无色下层紫色
难度: 简单查看答案及解析
-
某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为5∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A.1∶ 2 B.1∶ 4 C.3∶ 4 D.2∶ 5
难度: 简单查看答案及解析
-
下列实验操作能达到预期目的是( )
A.向某无色液中加BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42-
B.向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32-
C.向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明原溶液一定有Fe2+
D.将淀粉溶液和食盐溶液混合装入半透膜,浸入纯水中,过一段时间,取半透膜内的液体滴入碘水呈蓝色说明利用渗析可提纯胶体
难度: 简单查看答案及解析
-
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
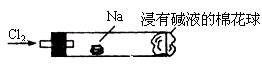
A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 若在棉球外沿滴一滴淀粉碘化钾溶液,可根据颜色变化判断氯气是否被碱液完全吸收
难度: 简单查看答案及解析
-
甲、乙、丙三种溶液中各含Cl-、Br-、I-中的一种卤离子,向甲溶液中加入淀粉溶液和适量氯水,溶液变成橙色,再加入丙溶液,颜色无变化,则甲乙丙三种溶液分别含有卤离子是 ( )
A. Cl-、Br-、I- B.I-、Br-、 Cl-
C.Br-、 Cl-、I- D. Br-、I- 、Cl-
难度: 简单查看答案及解析
-
3个SO32-恰好将2个XO4-离子还原,则X元素在还原产物中的化合价是( )
A.+1 B.+2 C.+3 D.+4
难度: 简单查看答案及解析
 (2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中微粒直径的范围是____________nm。
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中微粒直径的范围是____________nm。