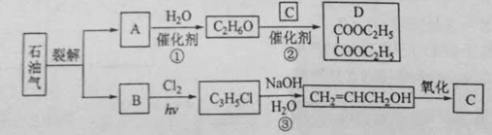
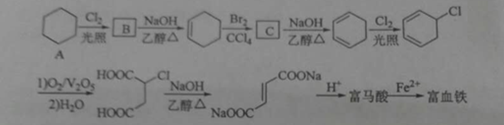
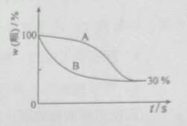
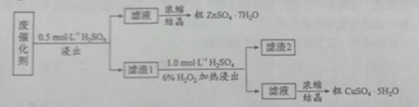
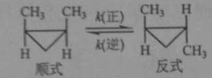-
下列物质中,其主要成分不属于烃的是
A.汽油 B.甘油 C.煤油 D.柴油
难度: 中等查看答案及解析
-
下列物质不可用作食品添加剂的是
A.谷氨酸单钠 B.柠檬酸 C.山梨酸钾 D.三聚氰胺
难度: 中等查看答案及解析
-
下列反应可用离子方程式“H++OH−=H2O” 表示的是
A.NaHSO4溶液与Ba(OH)2溶液混合
B.NH4Cl溶液与Ca(OH) 2溶液混合
C.HNO3溶液与KOH溶液混合
D.Na2HPO4溶液与NaOH溶液混合
难度: 中等查看答案及解析
-
下列叙述错误的是
A.氦气可用于填充飞艇
B.氯化铁可用于硬水的软化
C.石英砂可用于生产单晶硅
D.聚四乙烯可用于厨具表面涂层
难度: 中等查看答案及解析
-
向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
A.c(
)B.c(
) C.c(H+) D.Ksp(Mg
)
难度: 中等查看答案及解析
-
油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)
已知燃烧1kg该化合物释放出热量3.8×104kJ。油酸甘油酯的燃烧热△H为
A.3.8×104kJ·mol-1 B.-3.8×104kJ·mol-1
C.3.4×104kJ·mol-1 D.-3.4×104kJ·mol-1
难度: 中等查看答案及解析
-
下列实验设计正确的是
A.将SO2通入溴水中证明SO2具有漂白性
B.将铁屑放入稀HNO3中证明Fe比H2活泼
C.将澄清石灰水滴入某溶液证明其中存在
D.将乙烯通入KmnO4酸性溶液证明乙烯具有还原性
难度: 中等查看答案及解析
-
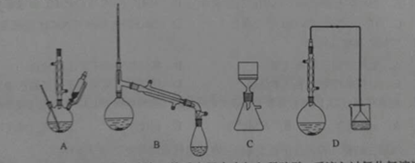
下列有关实验操作的叙述错误的是
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
难度: 中等查看答案及解析
-
利用太阳能分解制氢,若光解0.02 mol水,下列说法正确的是
A.可生成H2的质量为0.02g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224L(标准情况)
D.生成H2的量理论上等于0.04mol Na与水反应产生H2的量
难度: 中等查看答案及解析
-
某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是
A.Zn为电池的负极
B.正极反应式为2Fe
+
=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时
向负极迁移
难度: 中等查看答案及解析
-
由反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是
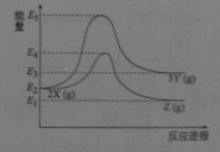
A.由
反应的ΔH=E5−E2
B.由
反应的ΔH<0
C.降低压强有利于提高Y的产率
D.升高温度有利于提高Z的产率
难度: 中等查看答案及解析
-
工业上可由乙苯生产苯乙烯:
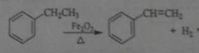 ,下列说法正确的是
,下列说法正确的是A.该反应的类型为消去反应
B.乙苯的同分异构体共有三种
C.可用Br2/CCl4鉴别乙苯和苯乙烯
D.乙苯和苯乙烯分子内共平面的碳原子数均为7
难度: 中等查看答案及解析
-
下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为2︓1的有
A.乙酸甲酯 B.对苯二酚 C.2-甲基丙烷 D.对苯二甲酸
难度: 中等查看答案及解析
-
下列叙述正确的有
A.第四周期元素中,锰原子价电子层中未成对电子数最多
B.第二周期主族元素的原子半径随核电荷数增大依次减小
C.卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小
难度: 中等查看答案及解析