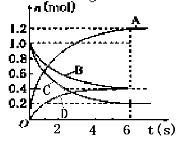
-
下列有关吸热反应、放热反应的叙述中,正确的是
①如果反应物的总能量低于生成物的总能量,该反应一定是吸热反应。
②只要是在加热条件下进行的反应,一定是吸热反应
③只要是在常温常压下进行的反应,一定是放热反应
④中和反应和燃烧反应都是放热反应
⑤化合反应都是放热反应
⑥原电池反应可能是放热反应,也可能是吸热反应
A.① ④ B.① ② ③ C.④ ⑤ ⑥ D.① ④ ⑤ ⑥
难度: 中等查看答案及解析
-
已知下列数据:Fe(s) + 1/2O2(g) = FeO(s) ΔH=-272kJ/mol;2Al(s) + 3/2O2(g) = Al2O3(s) ΔH=-1675kJ/mol;则2Al(s) + 3FeO(s) = Al2O3(s) + 3Fe(s)的ΔH是
A.-859 kJ/mol B.+859 kJ/mol C.-1403 kJ/mol D.-2491 kJ/mol
难度: 中等查看答案及解析
-
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的物质的量;⑥反应前后的温度变化;⑦操作所需时间;
A.①②③⑥⑦ B.①③④⑤ C.③④⑤⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
下列热化学方程式书写及说法正确的是
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= - 890 kJ
B.C(s)+1/2O2(g)=CO(g) ΔH= - 101.5 kJ·mol-1,该方程式的ΔH可表示碳的燃烧热
C.Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l) ΔH= - 2a kJ·mol-1,则任何强酸和强碱发生中和反应生成1mol H2O(l)的反应热均为-a kJ·mol-1
D.2mol氢气燃烧得水蒸气放热484 kJ,则H2O(g)=H2(g)+1/2O2(g) ΔH= + 242 kJ·mol-1
难度: 中等查看答案及解析
-
下列叙述正确的是
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
难度: 中等查看答案及解析
-
下列说法错误的是
A.做一次完整的中和热测定实验,温度计至少需使用3次
B.在有盐桥构成的铜(硫酸铜)-锌(硫酸锌)原电池中,盐桥中的阳离子移向电池的锌极
C.利用盖斯定律可间接计算通过实验难测定的反应的反应热
D.可以借助分光光度计采用比色的方法测定某反应的化学反应速率
难度: 中等查看答案及解析
-
下列关于下图装置的说法正确的是
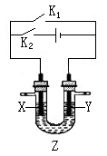
A.若断开K1关闭K2,X、Y均为石墨,Z是NaCl溶液,则X 附近能得到氢氧化钠
B.若断开K1关闭K2,X是纯铜,Y是粗铜,Z是CuSO4溶液,则该装置可用于铜的精炼
C.若断开K2关闭K1,X是Cu,Y是Fe,Z是含有空气的海水,则该装置可用于保护Fe
D.若断开K2关闭K1,X是Cu,Y是Zn,Z是稀H2SO4,则在X极有气泡生成。
难度: 中等查看答案及解析
-
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是
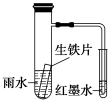
A.生铁片中的碳是原电池的阳极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水液面回升时,碳电极反应式为O2+2H2O+4e-===4OH-
D.具支试管中溶液pH逐渐减小
难度: 中等查看答案及解析
-
少量铁粉与100ml0.01mol/L稀盐酸反应。为了加快速率而不改变H2产量,可以使用如下方法中的:①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加NaCl溶液 ⑤滴加几滴硫酸铜溶液 ⑥适当升高温度(不考虑盐酸挥发) ⑦改用10ml 0.1mol/L的盐酸
A.③⑤⑥⑦ B.③⑥⑦ C.③④⑤⑥⑦ D.①③⑤⑦
难度: 中等查看答案及解析
-
反应2SO2(g)+O2(g)
2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
A.0.1 s B.2.5 s C.5 s D.10 s
难度: 中等查看答案及解析
-
四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g) 的速率测定实验,分别测得反应速率如下:①v(A)=0.15mol/(L·s) ②v(B)= 0.6mol/(L·s) ③v(C)= 0.5mol/(L·min) ④v(D)= 0.45mol/(L·s)。其中,反应进行得最快的是
A.① B.② C.③ D.④
难度: 中等查看答案及解析
-
一定温度下,反应N2+O2
2NO在密闭容器中进行,下列措施不改变化学反应速率的是
A.缩小体积使压强增大 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
难度: 中等查看答案及解析
-
工业合成氨反应为3H2(g) + N2(g) ⇋ 2NH3(g) ΔH<0,下列措施能使反应物中活化分子百分数增大的方法是
①增大N2的浓度;②升高温度;③增大压强;④移去NH3;⑤加入催化剂;
A.①②③ B.①②③⑤ C.①②③④⑤ D.②⑤
难度: 中等查看答案及解析
-
已知化学反应A2(g) + B2(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是
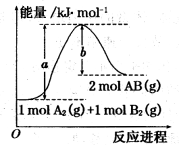
A.每生成2分子AB吸收bkJ热量
B.断裂1molA—A和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a-b)kJ/mol
难度: 中等查看答案及解析
-
下列关于判断过程的方向的说法正确的是
A.所有自发进行的化学反应都是放热反应
B.判断化学反应能否自发进行,必须综合考虑反应的焓变和熵变
C.自发反应一定是熵增大,非自发反应一定是熵减小的反应
D.同一物质的固、液、气三种状态中固体的熵值最大
难度: 中等查看答案及解析
-
可逆反应:2NO2
2NO+O2在固定体积的密闭容器中反应,不能说明已达到化学平衡状态的是
A.单位时间内生成n mol O2的同时生成2n mol NO2
B.混合气体的密度不再改变的状态
C.混合气体的颜色不再改变的状态
D.混合气体的平均相对分子质量不再改变的状态
难度: 中等查看答案及解析