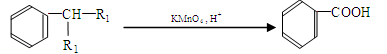-
化学与人类生活、社会可持续发展密切相关。下列有关叙述中不正确的是
A.“海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化
B.采用加热方法消毒的目的是使蛋白质变性而杀灭细菌
C.含有重金属的电器废品不能随意丢弃,要分类回收并利用
D.煤炭燃烧过程中安装“固硫”装置,主要是为了减少二氧化硫的排放
难度: 简单查看答案及解析
-
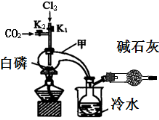
下列有关物质制取或性质探究实验设计不能达到实验目的的是
A.利用图1制取并收集干燥的氨气
B.利用图2制取Fe(OH)2,使用煤油的目的是防止生成的Fe(OH)2被空气氧化
C.利用图3制取并收集NO2气体
D.利用图4用酒精制取无水乙醇
难度: 中等查看答案及解析
-
下列有关有机化合物的结构和性质的叙述,正确的是
A.苯的硝化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应
B.C8H10含苯环的烃同分异构体有3种
C.乙烯、苯、乙烷分子中的所有原子都在同一平面上
D.莽草酸(
)能使溴的四氯化碳溶液褪色
难度: 简单查看答案及解析
-
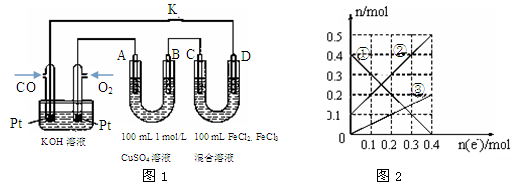
科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,下列说法不正确的是
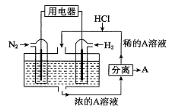
A.通入N2的电极发生的电极反应式为:N2 + 6e- + 8H+== 2NH4+
B.反应过程中溶液的pH会变大,故需要加入盐酸
C.该电池外电路电流从通入H2的电极流向通入N2的电极
D.通入H2的电极为负极,A为NH4Cl
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.稀硝酸中加入过量铁粉:Fe + 4H+ + NO=== Fe3+ + NO↑ + 2H2O
B.用铜作电极电解饱和食盐水:2Cl- + 2H2O
Cl2↑ + H2↑ + 2OH-
C.氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O=== Al(OH)3 ↓+ 3NH
D.向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+===Ba2++CO2↑+H2O
难度: 中等查看答案及解析
-
现有甲、乙、丙、丁四种短周期元素,它们之间的关系如下:
Ⅰ.原子半径:甲<丙<乙<丁
Ⅱ.原子的最外层电子数:甲+丙=乙+丁=8
Ⅲ.原子的核外电子层数:丁>乙=丙=2甲
Ⅳ.乙元素的主要化合价:最高正价+最低负价=2
则下列说法不正确的是
A.乙元素的最外层有5个电子,其氢化物含有极性键
B.四种元素中丙的非金属性最强,其最高价氧化物对应的含氧酸酸性最强
C.丁元素的氧化物对应的水化物与乙元素最高价氧化物对应水化物恰好完全反应形成的盐溶液显酸性
D.乙、丙两元素形成的简单氢化物稳定性丙的强于乙
难度: 中等查看答案及解析
-
根据下列各图曲线表征的信息,得出的结论不正确的是
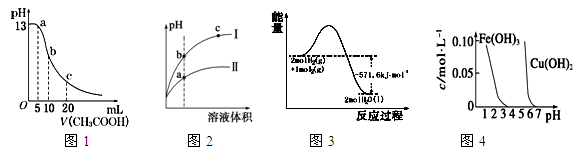
A.图1表示常温下向体积为10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C.图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D.由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
难度: 困难查看答案及解析