-
(14分)工业上用辉铜矿(主要成分Cu2S,含Fe3O4、SiO2杂质)为原料,生产硫酸铜晶体的工艺流程如下:
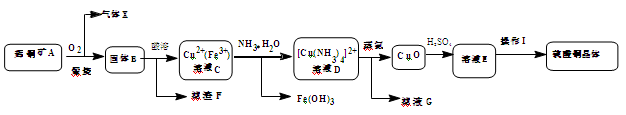
已知:①固体B为氧化物组成的混合物 ②[Cu(NH3)4]2+(aq)  Cu2+(aq) + 4NH3(aq)
Cu2+(aq) + 4NH3(aq)
(1)气体X是 ,高温下在过量空气中煅烧辉铜矿时,Cu2S发生反应的方程式为: 。
(2)固体B酸溶时加入稀硫酸和H2O2,目的是 ,不用浓硫酸的原因是 。
(3)鉴别溶液D中Fe3+完全除尽的方法是 。滤液G的主要溶质是 (填化学式)。
(4)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、 、烘干。
(5)用“间接碘量法”测定所制备的CuSO4·5H2O(不含能与I-反应的氧化性杂质)的纯度。取a g试样配成100 mL溶液,取25.00 mL该溶液,滴加KI溶液后有白色碘化物沉淀生成,滴加KI溶液至沉淀不再产生为止,然后用硫代硫酸钠标准溶液滴定生成的I2,发生反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6,消耗c mol·L-1 Na2S2O3溶液的体积为V mL。
①写出CuSO4与KI反应的离子方程式_________________________。
②计算试样中CuSO4·5H2O的纯度____________________(用a、c、V表示)。
-
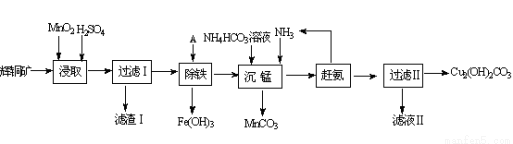
铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
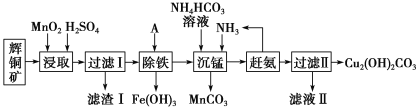
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有____(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:____。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为____mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____。
(5)“赶氨”时,最适宜的操作方法是____。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是____。
-
铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_________,若加 A 后溶液的 pH调为4.0,则溶液中 Fe3+的浓度为_________mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:_________________________。
(5)“赶氨”时,最适宜的操作方法是________________。
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是________________。
-
铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如图:
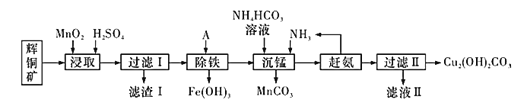
(1)加快“浸取”速率除将辉铜矿粉碎外,还可采取的措施有_________ (任写一种);研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是________。
(2)滤渣I中的主要成分是MnO2、S、SiO2。请写出“浸取”反应中生成S的化学方程式:________。
(3)常温下“除铁”时加入的试剂A可用____________较为合适,若加A后溶液的pH调为5,则溶液中Fe3+ 的浓度为______mol/L。{Ksp[Fe(OH)3]=4.0×10- 38}
(4)写出“沉锰"(除Mn2+ )过程中反应的离子方程式:______。
(5)“赶氨”时,最适宜的操作方法是__________。
(6)滤液II经蒸发结晶得到的盐主要是________(写化学式)。
-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
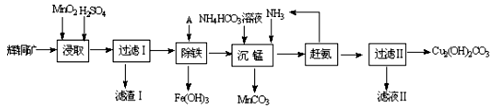
①浸取反应中氧化剂的化学式为 ;滤渣Ⅰ的成分为MnO2和 (写化学式)。
②“除铁”这一步反应在25℃进行,加入的试剂A为__________,若加A后溶液的PH调为4,溶液中Fe3+离子浓度为 mol/L。(已知Ksp[Fe(OH)3]= 4.0×10-38)
③“沉锰”(除Mn2+)过程中反应的离子方程式 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①下图1为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前电极质量相等,一段时间后,两电极质量相差25.8g,则导线中通过了_____ mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则乙池电解质溶液的质量与实验前的电解质溶液的质量差△m= g。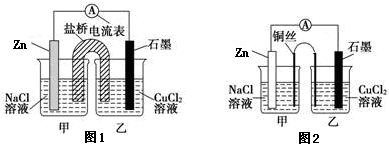
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如图2所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH___(填“减小”、“增大”或“不变”) ,乙池中石墨为_____极(填“正”、“负”、“阴”或“阳”) 。
-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
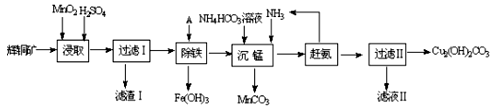
①浸取反应中氧化剂的化学式为 ;滤渣Ⅰ的成分为MnO2和 (写化学式)。
②“除铁”这一步反应在25℃进行,加入的试剂A为__________,若加A后溶液的PH调为4,溶液中Fe3+离子浓度为 mol/L。(已知Ksp[Fe(OH)3]= 4.0×10-38)
③“沉锰”(除Mn2+)过程中反应的离子方程式 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①下图1为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前电极质量相等,一段时间后,两电极质量相差25.8g,则导线中通过了_____ mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则乙池电解质溶液的质量与实验前的电解质溶液的质量差△m= g。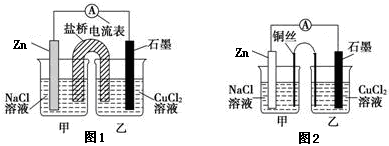
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如图2所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH___(填“减小”、“增大”或“不变”) ,乙池中石墨为_____极(填“正”、“负”、“阴”或“阳”) 。
-
铜及其化合物在工业上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
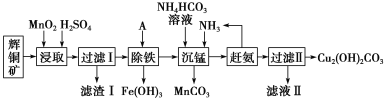
(1)“浸取”反应中氧化剂的化学式为________;若“浸取”反应中得到一种单质,则滤渣Ⅰ的成分为 MnO2 和________、________ (写化学式)。
(2)“除铁”这一步反应在 25 ℃ 进行,加入的试剂 A 为________,若加 A 后溶液 的 pH调为 4,溶液中 Fe3+浓度为______mol/L。{已知 Ksp[Fe(OH)3]=4.0×10-38}
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:________________________________。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是__________(写化学式)。
(5)过滤Ⅱ的沉淀经过洗涤、干燥可以得到碱式碳酸铜,如何判断沉淀已洗净?_____________________________。
-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
①浸取反应中氧化剂的化学式为________ ;滤渣Ⅰ的成分为MnO2、S和___________(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过_______ mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式_________________________ 。
④滤液Ⅱ经蒸发结晶得到的盐主要是______________ (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则电解过程中盐桥中Cl-移向______________(填“甲池”或“乙池”)
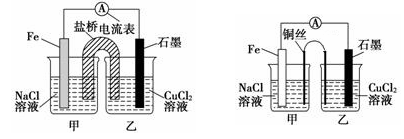
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH________(填“减小”、“增大”或“不变”) ,乙池中石墨为________极(填“正”、“负”、“阴”或“阳”)。
-
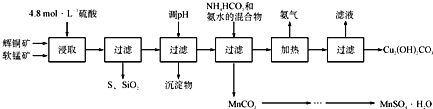
辉铜矿主要成分Cu2S,软锰矿主要成分MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
已知:
①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③MnSO4·H2O易溶于冷水,不溶于酒精;
④部分金属阳离子氢氧化物的(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算:当离子浓度小于1.0×10-5时,认为该离子沉淀完全。):
Ksp(Fe(OH)3)=1.0×10-38, Ksp(Cu(OH)2)=1.0×10-20, Ksp(Mn(OH)2)=4.0×10-14
(1)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式_________________________________。
(2)调pH的范围为____________。
(3)在该工艺中可循环使用的物质是______________;“加热驱氨” 环节,温度不能过低也不能过高的原因为___。
(4)请根据如下图示,将“由碳酸锰经一系列操作获得MnSO4·H2O晶体,并测定纯度”的实验方案补充完整。
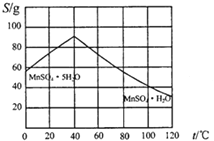
①将碳酸锰固体溶于稀硫酸获得硫酸锰溶液;
②加热溶液并控制温度>40℃,_________得到粗产品;
③_______,低温干燥,可得到较纯晶体。
④欲测定该品体的纯度,取14.00g晶体加蒸馏水配成100mL溶液,量取25.00mL,加足量标准BaCl2溶液,得到沉淀4.66g,则此样品的纯度为___(保留四位有效数字)。某小组计算发现本组样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有__(任写一种)。
-
辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
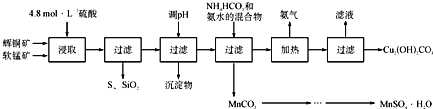
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
| | 开始沉淀的pH | 沉淀完全的pH |
| Fe 3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
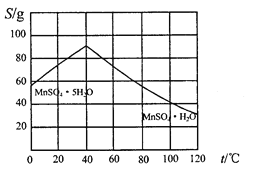
(6)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。

Cu2+(aq) + 4NH3(aq)













