-
下列说法正确的是( )
A.化学反应的焓变与反应的途径无关
B.盐酸与氢氧化钠溶液的反应中一定有化学键的断裂和形成
C.白酒的蒸馏、石油的分馏、煤的干馏都是化学变化
D.研发新型催化剂,提高石油和煤中各组分的燃烧热
难度: 简单查看答案及解析
-
下列分别是利用不同能源发电的实例,其中不属于新能源开发利用的是( )
A.风力发电 B.太阳能发电 C.火力发电 D.潮汐能发电
难度: 简单查看答案及解析
-
用锌片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热 B.改用98%的浓硫酸
C.改用锌粒 D.滴加少量CuSO4溶液
难度: 简单查看答案及解析
-
在恒容条件下,能使NO2(g)+CO(g)
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增加的措施是( )
A.增大NO2或CO的浓度 B.减小CO2或NO的浓度
C.通入Ne使气体的压强增大 D.升高反应的温度
难度: 中等查看答案及解析
-
下列关于化学反应与能量的说法正确的是( )
A.CaO+H2O=Ca(OH)2是放热反应,说明CaO的能量大于Ca(OH)2的能量
B.化学反应中一定有物质变化但不一定有能量变化
C.由H2→2H的过程需要吸收能量
D.Ba(OH)2·8H2O晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A.0.1 mol·L–1 Na2SO4溶液含有的钠离子数目为0.2NA
B.标准状况下,22.4 L 四氯化碳(CCl4)含有的碳原子数目为NA
C.常温常压下,32 g O3含有的氧原子数目为2NA
D.56 g的Fe与足量的稀盐酸完全反应转移电子数为3NA
难度: 中等查看答案及解析
-
在做中和热实验测定中和热时,应使用的仪器正确的组合是( )
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
A.①②④⑤ B.②③⑤ C.②③④⑦ D.全部
难度: 中等查看答案及解析
-
下列各组变化中,前者是放热反应,后者是吸热反应的是( )
A.生石灰溶于水;锌粒和稀硫酸反应
B.稀释浓硫酸;金属或金属氧化物熔化
C.氢氧化钠和盐酸反应;二氧化碳和碳反应
D.工业煅烧石灰石;化石燃料燃烧
难度: 中等查看答案及解析
-
可逆反应2A(g)+3B(g)
2C(g)+D(g)在四种不同条件下的反应速率分别为:①υ(A)=0.5 mol/(L·min) ②υ(B)=0.6 mol/(L·min) ③υ(C)=0.35 mol/(L·min) ④υ(D)=0.4 mol/(L·min)。则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
难度: 中等查看答案及解析
-
下列说法正确的是( )
①活化分子间的碰撞一定能发生化学反应 ②普通分子有时也能发生有效碰撞
③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应实质是活化分子有合适取向时的有效碰撞
A.①②⑤ B.③④⑥ C.③④⑤⑥ D.②③④
难度: 中等查看答案及解析
-
X、Y、Z、W为短周期元素,且原子序数依次增大。已知X原子的最外层电子数是其内层电子数的3倍,Y原子最外层只有一个电子,Z是地壳中含量最高的金属元素,W与X属于同一主族。下列说法正确的是( )
A. 金属性:Z>Y
B. 元素X和Y只能形成一种化合物
C. 原子半径:W>Z>Y>X
D. Y、Z、W的最高价氧化物对应的水化物均能相互反应
难度: 困难查看答案及解析
-
对于反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,在测量化学反应速率时,以下相关性质不可以利用的为( )
A.气体的体积和体系的压强
B.溶液颜色的深浅
C.H+浓度的变化
D.固体物质的体积
难度: 中等查看答案及解析
-
四种X溶液分别加入四个盛有10 mL 2 mol/L盐酸的烧杯中,均加水稀释到50 mL,假设混合和稀释是瞬间完成的,则开始的瞬间反应速率最大的是( )
A.20 mL 2 mol/L 的X溶液 B.10 mL 4 mol/L 的X溶液
C.20 mL 3 mol/L 的X溶液 D.10 mL 2 mol/L 的X溶液
难度: 中等查看答案及解析
-
在密闭容器里,A与B反应生成C,其反应速率分别用υA、υB、υC表示,已知2υB =3υA、3υC=2υB,
则此反应可表示为( )
A.A+3B=2C B.2A+3B=2C C.3A+B=2C D.A+B=C
难度: 中等查看答案及解析
-
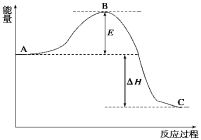
如图所示,ΔH1=-393.5kJ·mol﹣1,ΔH2=-395.4kJ·mol﹣1,下列说法或表示式正确的是( )
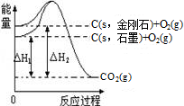
A.C(s,石墨)=C(s,金刚石) ΔH=-1.9 kJ·mol﹣1
B.石墨和金刚石的转化是物理变化
C.石墨的稳定性强于金刚石
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol--1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a>b
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ
D.已知P (白磷,s)=P (红磷,s) ΔH<0,则白磷比红磷稳定
难度: 中等查看答案及解析
-
已知N2+O2=2NO为吸热反应,ΔH=+180 kJ·molˉ1,其中N≡N、O=O键的键能分别为946 kJ·molˉ1、498 kJ·molˉ1,则N-O键的键能为( )
A.1264 kJ·mol﹣1 B.632 kJ·mol﹣1 C.316 kJ·mol﹣1 D.1624 kJ·mol﹣1
难度: 中等查看答案及解析
-
在可逆反应2A(g)+3B(g)
xC(g)+D(g)中,已知起始浓度A为5 mol/L,B为3 mol/L,C的反应速率为0.5 mol/(L·min),2 min后,测得D的浓度为0.5 mol/L。则关于此反应的下列说法中正确的是( )
A.2 min末时,A和B的浓度之比为5∶3
B.x=1
C.2 min末时,B的浓度为1.5 mol/L
D.2 min末时,A的消耗浓度为0.5 mol/L
难度: 中等查看答案及解析
-
将Υ1 L的H2和Υ2 L的N2在一定条件下发生反应,达到平衡后,混合气体总体积为Υ3 L(气体体积均在相同条件下测定),则生成NH3的体积是( )
A.(Υ1+Υ2-Υ3)L B.(Υ1+Υ2+Υ3)L
C.(Υ1+Υ2-2Υ3)L D.
[Υ3-(Υ1+Υ2)] L
难度: 中等查看答案及解析
-
不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l) ΔH1=Q1 kJ·molˉ1;
C2H5OH(g)=C2H5OH(l) ΔH2=Q2 kJ·molˉ1;
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=Q3kJ·molˉ1。若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3)
C.0.5Q1-1.5Q2+0.5Q3 D.-1.5Q1+0.5Q2-0.5Q3
难度: 困难查看答案及解析