-
化学与生活、社会密切相关,下列说法正确的是( )
A. 将矿物燃料脱硫脱硝可有效防止酸雨
B. 通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2
C. 高锰酸钾溶液、酒精、双氧水能杀菌消毒,都利用了强氧化性
D. 以“地沟油”为原料生产的生物柴油与以“石油”为原料生产的柴油化学成分相似
难度: 中等查看答案及解析
-
2017年5月9 日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如293117Ts、294117Ts等。下列说法正确的是( )
A. 293117Ts和294117Ts的化学性质不同 B. Ts位于周期表的第六周期ⅦA族
C. 元素Ts的相对原子质量为293.5 D. 293117Ts和294117Ts质子数相同,中子数不同
难度: 简单查看答案及解析
-
下列反应中,反应后固体质量减轻的是( )
A. 水蒸气通过灼热的铁粉
B. Cu2S在O2 中灼烧转变为CuO
C. 将铜丝插人FeCl3溶液中片刻
D. 含水蒸气的CO2 通过盛有Na2O2 的干燥管
难度: 中等查看答案及解析
-
中国传统文化对人类文明贡献巨大,《本草纲目》中有如下记载:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用KNO3的性质是( )
A. 自燃性 B. 稳定性 C. 还原性 D. 氧化性
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 新制饱和氯水中:Al3+、Cu2+、SO42-、Br-
B. 使甲基橙变红的溶液中:Mg2+、Fe3+、NO3-、SCN-
C.
=1×10-13mol·L-1的溶液中:Na+、K+、C1-、AlO2-
D. 由水电离的c(H+)=1×10-13mol·L-1的溶液中:Ca2+、Ba2+、Cl-、HCO3-
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 乙烯和乙醇都能发生加成反应
B. 乙酸和四氯化碳都可萃取溴水中的Br2
C. 苯和四氟乙烯分子中的所有原子均处于同一平面
D. 糖类、油脂及蛋白质均只由碳、氢、氧三种元素组成
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是( )
A. 用量筒量取25.00mLNa2CO3溶液
B. 用排水法收集NH4Cl 与Ca(OH)2 共热制得的氨气
C. 用澄清石灰水检验木炭与浓硫酸共热产生的气体中的CO2
D. 向溶有NO2 的黄色浓硝酸中通入足量O2,使其变为无色
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是( )
选项
化学性质
实际应用
A
NH3具有还原性
用作食品工业的制冷剂
B
K2FeO4 易与H2O反应生成Fe(OH)3
用作水的消毒剂和絮凝剂
C
Ag2O具有氧化性
用作银锌纽扣电池正极的活性物质
D
硫酸铝能与小苏打溶液反应
用作泡沫灭火剂原料
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 标准状况下,2.24L SO3中含有0.1NA个SO3 分子
B. 向1L的密闭容器中充入46gNO2气体,容器中气体的分子数为NA
C. 常温下,将2.7g铝片投入足量的浓硫酸中,转移电子的数目为0.3NA
D. 常温常压下,7.0g由丁烯与丙烯组成的混合气体中含有的氢原子数目为NA
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 氧化钠投入水中:O2-+H2O=2OH-
B. FeCl3溶液与HI反应:2Fe3++2I-=2Fe2++I2
C. 硫酸氢铵与过量氢氧化钡溶液反应:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O
D. 过量CO2通入Ca(ClO)2 溶液中:H2O+CO2+Ca2++2ClO-=2HClO+CaCO3↓
难度: 困难查看答案及解析
-
一种生产和利用氢能的途径如图所示。下列说法错误的是( )
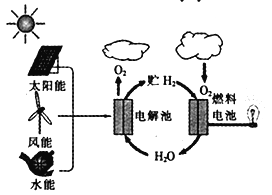
A. 氢能属于二次能源 B. 图中能量转化的方式至少有6种
C. 太阳能电池的供电原理与燃料电池相同 D. 太阳能、风能、氢能都属于新能源
难度: 中等查看答案及解析
-
H2S的分解反应是一个可逆反应,其能量与反应进程的关系如图所示,下列有关说法正确的是( )
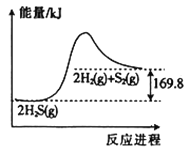
A. 正反应的活化能大于逆反应的活化能
B. 若减小体系的压强,则该反应的焓变将增大
C. 升高温度,化学反应速率加快,H2S的平衡转化率减小
D. 向密闭容器中充入1mol H2S充分反应,吸收84.9 kJ的热量
难度: 困难查看答案及解析
-
由丁醇(X)制备戊酸(Z)的合成路线如图所示,下列说法错误的是( )
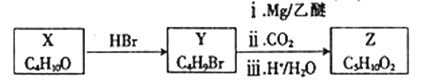
A. Y的结构有4种
B. X、Z能形成戊酸丁酯,戊酸丁酯最多有16种
C. 与X互为同分异构体,且不能与金属钠反应的有机物有4种
D. 与Z互为同分异构体,且能发生水解反应的有机物有9种
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,说明该反应的△H<0
B. 加水稀释0.1mol·L-1的CH3COONa溶液后,溶液中
的值增大
C. 氟元素的非金属性强于溴元素,由此可推出酸性:HF>HBr
D. 用等物质的量浓度的NaOH溶液中和等体积且pH均为2的盐酸和醋酸溶液,盐酸消耗的NaOH 溶液体积更多
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的电子数是其电子层数的3倍,Y的非金属性在所有短周期元素中最强,Z的最外层电子数与最内层电子数相等,W是地壳中含量第二多的元素。下列叙述正确的是( )
A. 原子半径的大小顺序:r(Z)>r(W)>r(Y)>r(X)
B. Y的单质与H2化合时,点燃安静燃烧,光照则会发生爆炸
C. 最简单气态氢化物的稳定性:X>W
D. 工业上用电解含Z的简单离子水溶液的方法制取单质Z
难度: 困难查看答案及解析
-
实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:
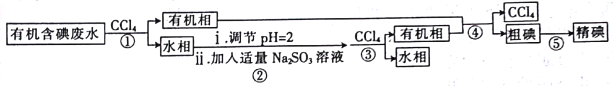
已知:碘的熔点为113℃,但固态的碘可以不经过熔化直接升华。下列说法错误的是
A. 操作①和③中的有机相从分液漏斗下端放出
B. 操作②中发生反应的离子方程式为2IO3- +5SO32-+2H+=I2+5SO42-十H2O
C. 操作④中用到的玻璃仪器仅需温度计、球形冷凝管、酒精灯、接引管及锥形瓶
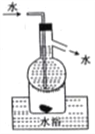
D. 操作⑤可用如图所示的水浴装置进行
难度: 困难查看答案及解析
-
直接煤一空气燃料电池原理如图所示,下列说法错误的是( )
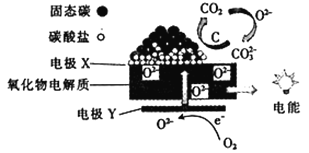
A. 随着反应的进行,氧化物电解质的量不断减少
B. 负极的电极反应式为C+2CO32--4e-=3CO2↑
C. 电极X为负极,O2-向X极迁移
D. 直接煤一空气燃料电池的能量效率比煤燃烧发电的能量效率高
难度: 困难查看答案及解析
-
下图所示与对应叙述不相符的是( )
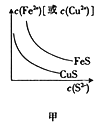
A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
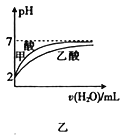
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH 变化曲线,则酸性:甲酸<乙酸
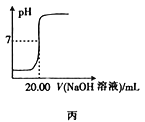
C. 25℃时,图丙表示用0.100mol·L-1的NaOH溶液滴定25.00mL盐酸的滴定曲线,则c(HCl)=0.080 mol·L-1
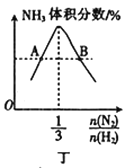
D. 图丁表示反应N2(g)+3H2(g)
2NH3(g)平衡时NH3体积分数随起始
变化的曲线,则转化率:aA(H2)<aB(H2)
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向鸡蛋清溶液中滴加饱和Na2SO4溶液
有固体析出
Na2SO4能使蛋白质发生变性
B
向淀粉KI溶液中滴加氯水至过量
溶液先变蓝后褪色
I-先被氧化成I2,后可能继续被氧化成其他物质
C
向浓度均为0.1 mol·L-1的NaCl和Na2SiO3溶液中分别滴加酚酞
NaCl溶液不变色,Na2SiO3溶液变成红色
非金属性:Si<Cl
D
向浓度均为0.1 mol·L-1 NaCl和Na2CrO4混合溶液中滴加0.1 mol·L-1 AgNO3溶液
先生成白色的AgCl沉淀
Ksp(AgCl)<Ksp(Ag2CrO4)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学上常用AG 表示溶液中的酸碱度,AG=lg
。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1HNO2溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是( )
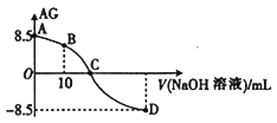
A. D点溶液中的pH=11.25
B. B点溶液中存在c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积为20.00 mL
D. 25℃时,HNO2 的电离平衡常数Ka=1.0×10-5.5
难度: 困难查看答案及解析
-
有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)
2Cl2(g)+2H2O(g) △H。HCl的平衡转化率与Z和T的关系如图所示。
容器
起始时
T/℃
n(HCl)/mol
Z
Ⅰ
300
0.25
a
Ⅱ
300
0.25
b
Ⅲ
300
0.25
4
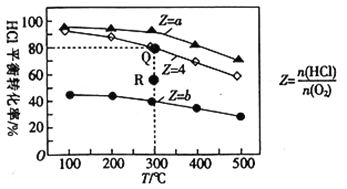
下列说法不正确的是( )
A. △H<0
B. a<4<b
C. 若容器Ⅲ反应某时刻处于R点,则R点的反应速率:v(正)>v(逆)
D. 300 ℃时,该反应平衡常数的值为320
难度: 困难查看答案及解析
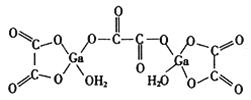
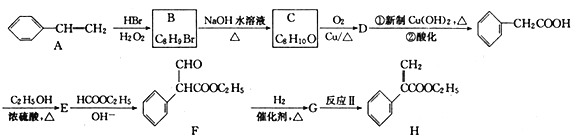
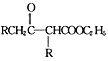 +C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:
+C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下: