-
(原创)化学与生产生活有密切的联系。以下说法正确的是
A.埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的
B.气象环境报告中新增的“PM2.5”是对一种新分子的描述
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.施肥时,草木灰(有效成分为K2CO3)与NH4Cl混合使用效果更好
难度: 中等查看答案及解析
-
(原创)工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出。下列说法错误的是
A.氧化性:H2SeO4>Cl2;H2SeO3>H2SO4
B.酸性:H2SO4>H2SeO4> H2SeO3
C.析出l mol硒需要消耗标准状况下22.4 L SO2
D.亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸
难度: 困难查看答案及解析
-
下列与金属腐蚀有关的说法正确的是
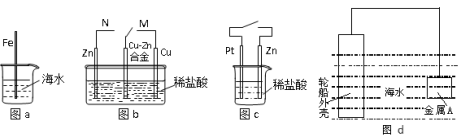
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
难度: 困难查看答案及解析
-
实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是
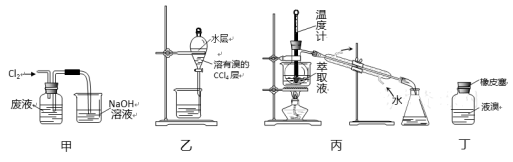
A.用装置甲氧化废液中的溴化氢 B.用装置乙分离油层和水层
C.用装置丙分离四氯化碳和液溴 D.用仪器丁密封存放单质溴
难度: 中等查看答案及解析
-
(原创)以下说法错误的是
A.银氨溶液可用于区分麦芽糖和葡萄糖
B.乙烷、乙醛、乙酸的沸点逐渐升高
C.1mol乙酰水杨酸(
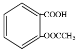 )最多可以和3molNaOH反应
)最多可以和3molNaOH反应D.邻甲基苯酚(
)可以和HCHO发生缩聚反应
难度: 中等查看答案及解析
-
(原创)下列相关的离子方程式书写正确的是
A.NaHS溶液水解: HS- + H2O
S2- + H3O+
B.向Ca(C1O)2溶液中通入SO2:SO2+2ClO-+H2O=SO32-+2HClO
C.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42ˉ刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
难度: 中等查看答案及解析
-
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质
NaF
NaClO
Na2CO3
pH
7.5
9.7
11.6
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:C(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
难度: 中等查看答案及解析
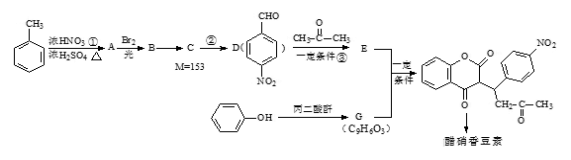
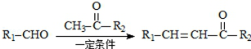 +H2O
+H2O