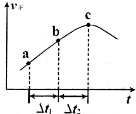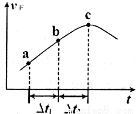-
(原创)化学反应原理在生产和科研中有着重要的应用,请利用相关知识回答下列问题。
(1)一定条件下在密闭容器中加入NH4I发生反应:
a.NH4I(s)  NH3(g)+HI(g)
NH3(g)+HI(g)
b.2HI(g)  H2(g)+I2(g)
H2(g)+I2(g)
则反应a的平衡常数表达式为_______;达到平衡后,扩大容器体积,反应b的移动方向_______(填正向、逆向或不移动)
(2)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2 N2O4 △H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
N2O4 △H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
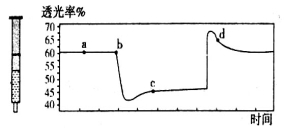
A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc
D.d点: (正)>
(正)>  (逆)
(逆)
(3)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
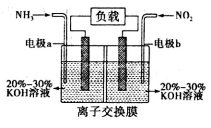
①电极a为______极,其电极反应式为________________
②当有2.24 L NO2(标准状况下)被处理时,转移电子为____________mol
③为使电池持续放电,该离子交换膜需选用_______(选填“阳”或“阴”)离子交换膜。
(4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式______________________________。
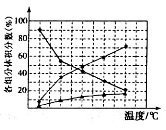
②在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,为抑制肼的分解,可采取的合理措施有_________________________________ (任写一种)。
-
(18分)化学反应原理在生产和科研中有着重要的应用,请利用相关知识回答下列问题。
(1)一定条件下在密闭容器中加入NH4I发生反应:

则反应a的平衡常数表达式为_________;达到平衡后,扩大容器体积,反应b的移动方向_______(填正向、逆向或不移动)
(2)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2  N2O4 ∆H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4 ∆H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
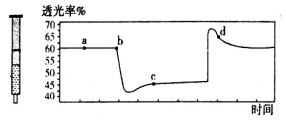
A.b点的操作是压缩注射器
B.c点与a点相比, 增大,
增大, 减小
减小
C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc
D.d点: (正)>
(正)>  (逆)
(逆)
(3)利用反应 构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。

①电极a为__________极,其电极反应式为_________________。
②当有2.24LNO2(标准状况下)被处理时,转移电子为____________mol。
③为使电池持续放电,该离子交换膜需选用____________交换膜。
(4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式_______________________。
②在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,为抑制肼的分解,可采取的合理措施有____________(任写一种)。

-
请应用化学反应原理的相关知识解决下列问题:
 已知NaCl的溶解热为
已知NaCl的溶解热为 吸热
吸热




写出钠在氯气中燃烧的热化学方程式:__________。
 一定条件下,在
一定条件下,在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 发生反应:
发生反应: ,如图所示为反应体系中
,如图所示为反应体系中 的平衡转化率与温度的关系曲线。已知在温度为
的平衡转化率与温度的关系曲线。已知在温度为 的条件下,该反应
的条件下,该反应 达到平衡状态;
达到平衡状态;

 该反应是________
该反应是________ 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。
 在
在 时段反应速率
时段反应速率 为_________。
为_________。
 若改充入
若改充入 和
和 ,图中的曲线会_________
,图中的曲线会_________ 填“上移”或“下移”
填“上移”或“下移” 。
。
 根据下表数据回答问题:
根据下表数据回答问题:
表1  时浓度为
时浓度为 两种溶液的pH
两种溶液的pH
表2  时两种酸的电离平衡常数
时两种酸的电离平衡常数
 根据表1能不能判断出
根据表1能不能判断出 与HClO酸性强弱?_____________
与HClO酸性强弱?_____________ 填“能”或“不能”
填“能”或“不能” 。
。
 溶液中离子浓度由大到小的顺序为__________。
溶液中离子浓度由大到小的顺序为__________。
 溶液和
溶液和 溶液反应的离子方程式为________。
溶液反应的离子方程式为________。
 已知:
已知: 时,
时, 、
、 ;AgCl为白色沉淀,
;AgCl为白色沉淀, 为砖红色沉淀。
为砖红色沉淀。 时,向
时,向 和
和 浓度均为
浓度均为 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液至过量且不断搅拌,实验现象为__________。
溶液至过量且不断搅拌,实验现象为__________。
-
化学反应原理在科研和生产中有广泛应用。CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)  CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度/(mol·L-1) | 0.9 | 1.0 | 0.6 |
(1)反应达到平衡时,CO的转化率为________。
(2)该反应的平衡常数K=________。
(3)恒温恒容条件下,可以说明反应已达到平衡状态的是________(填字母)。
A.v正(CO)=2v逆(H2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(4)若将容器体积压缩到1 L,则达到新平衡时c(H2)的取值范围是__________。
(5)若保持容器体积不变,再充入0.6 mol CO和0.4 mol CH3OH,此时v正__v逆(填“>”“<”或“=”),平衡_____________移动。
-
含氮化合物在化学工业中有着重要的应用,回答下列问题:
(1)一定条件下,硝酸铵加热分解得到的产物只有N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的平衡常数表达式为K=___________;若有1mol硝酸铵完全分解,则转移电子的数目为___________(设NA为阿伏加德罗常数的值)。
(2)硝基苯甲酸乙酯在碱性条件下发生反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
| t/s | 0 | 60 | 90 | 120 | 160 | 260 | 300 | 360 | 400 |
| a/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
①该反应在60~90s与90~120s内的平均反应速率分别约为___________,___________;比较两者大小可得出的结论是______________________。
②计算T℃时该反应的平衡常数为______________________。
③为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施为______________________(写出一条即可)。
-
(14分)化学反应原理在科研和工农业生产中有广泛应用。
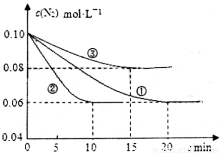
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)  2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
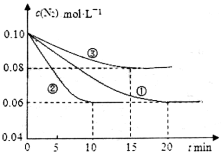
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
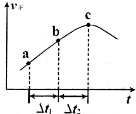
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
-
化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g)
2NH3(g)  。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间
。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间 的变化如下图所示:
的变化如下图所示:
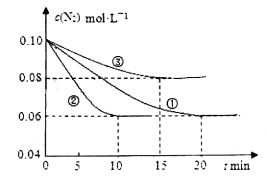
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=_______________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
a.增大压强 b.减小压强 c.升高温度 d.降低温度 e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol·L ,则该反应的平衡常数K=_______________;
,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
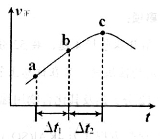
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C. 时,NO2的转化率:a~b段小于 b~c段
时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol·L 的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3
的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数
H2O的电离平衡常数 =___________。
=___________。
-
氢在生活、生产、科研中发挥着重要的作用。
Ⅰ.工业上利用吸热反应C(s) +2H2O(g) CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
| 容器 | 容积/L | 温度/L | 起始量/mol | 平衡量/mol |
| C(s) | H2O(g) | H2(g) |
| 甲 | 2 | T1 | 3 | 4 | 3.2 |
| 乙 | 1 | T2 | 1.5 | 2 | 1.2 |
(l)T1_______T2 (填“>”、“ =”或“<”)。
(2)T1时达到平衡后再加入lmolH2O(g),达到新平衡后H2(g)的物质的量分数__________(填“增大”、“ 不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v(正)________v(逆)(填“大 于”、“ 等 于” 或“小于”)。
Ⅱ.CO(g)和H2(g)在一定条件下可合成甲醇:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
(3)该反应能量变化曲线如图所示,下列叙述正确的是___________。

A.该反应的△H>0
B.该反应的活化能为419kJ
C.使用催化剂后反应速率加快,△H 不变
D.若改变条件使平衡向正反应方向移动,则CO 的转化率可能增大,可能不变,也可能减小
(4)反应分別在230℃、250℃、270℃进行时,CO的平衡转化率与 的关系如图所示。
的关系如图所示。

①230℃对应的曲线是_________________,依据是________________。
②向容积为1L的密闭容器中投入1nolCO、3molH2,在上述某温度下进行反应,平衡后测得 =
= ,则反应温度为_____________,平衡常数K=_________________。
,则反应温度为_____________,平衡常数K=_________________。
-
化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
在l L密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=____________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的___________、_________(填字母编号)。
A增大压强 B减小压强 C升高温度 D降低温度 E使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_____________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将__________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
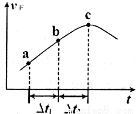
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将a mol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a__b。(填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
-
(12分)过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产
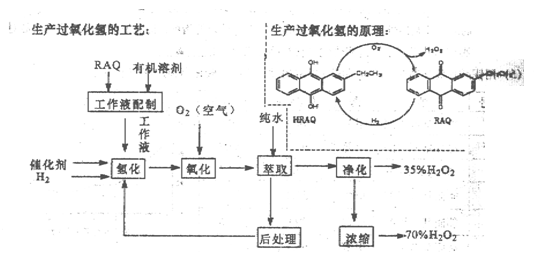
根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为________。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替?________
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是________。
A.适当加热 B.加压 C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是________。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是________。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为________。
NH3(g)+HI(g)
H2(g)+I2(g)
N2O4 △H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________

(正)>
(逆)