-
下列关于有机物结构、性质的分析正确的是
A. 2-甲基丙烷也称为异丙烷
B. 油脂和蛋白质都属于高分子化合物
C. 丙烯、苯分子的所有原子均在同一平面内
D. 葡萄糖与果糖互为同分异构体,均能与金属钠反应产生H2
难度: 简单查看答案及解析
-
化学与生产、生活息息相关,下列叙述不正确的是
A. 明矾水解时产生具有吸附性的胶体粒子,可用于饮用水的杀菌消毒
B. 小苏打是制作面包等糕点的膨松剂,也是治疗胃酸过多的常用药剂
C. 推广使用煤的液化技术,可提供清洁高效的燃料
D. 利用CO2合成可降解塑料——聚碳酸酯,实现了“碳”的循环利用
难度: 简单查看答案及解析
-
下列实验所对应的实验操作及实验目的均正确的是
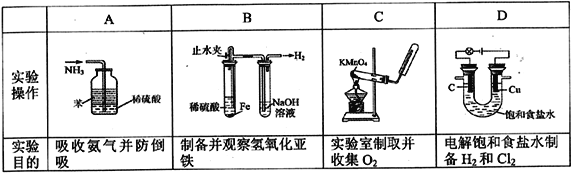
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是
A. 3molFe在过量的纯氧中完全燃烧,转移的电子数为9NA
B. 52g苯乙烯中含有的碳碳双键数目为0.5NA
C. 标准状况下,22.4LCO和N2的混合气体的分子数目为2NA
D. 1L0.1mol/LNa2CO3溶液中CO32-和HCO3-的总数为0.1NA
难度: 中等查看答案及解析
-
如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。下列关于该装置的说法错误的是
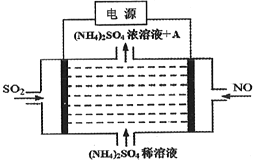
A. SO2通入阳极,该电极上发生氧化反应
B. 物质A为硫酸
C. 阴极的电极反应为: NO-5e-+6H+=NH4++H2O
D. (NH4)2SO4可作为肥料
难度: 困难查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,且W、X、Y、Z+的最外层电子数与电子层数的比值分别为1、2、3、4,下列说法正确的是
A. 简单离子半径:Y<Z
B. W 与X形成化合物的沸点一定低于W与Y形成化合物的沸点
C. Y与Z形成的化合物一定属于离子化合物
D. 由W、X、Y、Z四种元素组成的盐只有一种
难度: 中等查看答案及解析
-
浓度均为0.01mol·L-1、体积均为V1L的两种一元酸HX和HY的水溶液,加水稀释至体积为VL,测得两溶液pH随lg
变化的情况如图所示,下列说法错误的是
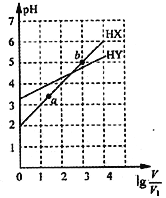
A. HY为一元弱酸 B. 将两种溶液无限稀释,由水电离产生的c(H+)相等
C. lg
=3时,升高温度,
增大 D. HX 的电离程度:b>a
难度: 困难查看答案及解析
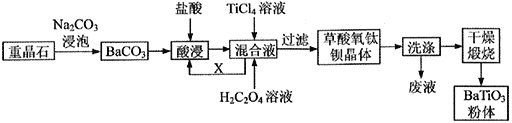
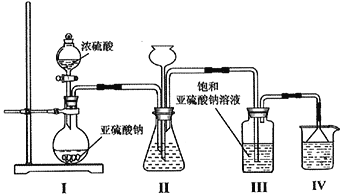
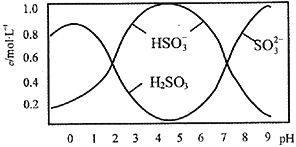

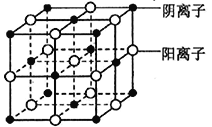
 ),其转化关系如下:
),其转化关系如下: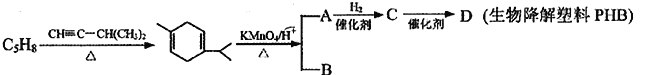
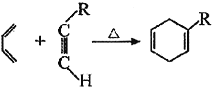
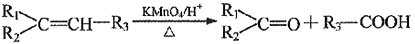
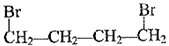 和H3C-C
和H3C-C 的路线流程图(无机试剂任选)_______,合成路线流程图示例如下:
的路线流程图(无机试剂任选)_______,合成路线流程图示例如下: