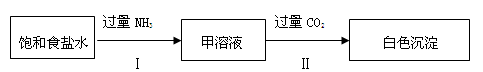
-
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A.过滤后的溶液中一定没有S2-
B.MnS难溶于水,可溶于MnCl2溶液中
C.常温时,CuS、PbS、CdS比MnS更难溶
D.加入MnS后生成CuS的离子方程式是Cu2+ + S2- = CuS↓
难度: 中等查看答案及解析
-
下列常见物质的分类不正确的是
A.CO2是酸性氧化物 B.氨水是混合物
C.冰醋酸是电解质 D.纯碱是碱
难度: 中等查看答案及解析
-
下列化学用语不能正确表示相应粒子的是
A.HClO的电子式:
B.C2H6的结构简式:CH3CH3
C.CO2的结构式:O=C=O
D.O2-的结构示意图:
难度: 简单查看答案及解析
-
重水(2H2O)是重要的核工业原料,下列说法不正确的是
A.氘(
)原子核内有1个质子
B.
与
是不同的核素
C.1H2O与2H2O是同一种物质
D.1H218O与2H216O的相对分子质量相同
难度: 简单查看答案及解析
-
下列说法正确的是
A.化合反应一定是放热反应
B.乙二醇和丙三醇都易溶于水和乙醇
C.牺牲阳极的阴极保护法是利用了电解原理
D.相同条件下,CuSO4溶液比FeCl3溶液使H2O2分解速率更快
难度: 简单查看答案及解析
-
下列有关物质性质说法不正确的是
A.热稳定性:HCl>HI B.原子半径:Na>K
C.元素的最高正价:S>Si D.氧化性: Br2<Cl2
难度: 简单查看答案及解析
-
常温时,在pH=13的无色透明溶液中一定能大量共存的一组离子是
A.Na+、SiO32-、NO3-、CO32- B.K+、Cl-、MnO4-、SO42-
C.Na+、NO3-、SO42-、HCO3- D.Na+、SO42-、NH4+、Cl-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法不正确的是
A.标准状况下,22.4 L O2含有的分子数为NA
B.常温常压下,3.4 g H2O2含有极性键的数目为0.2 NA
C.将含Na+数目为NA的NaCl固体溶于1 L水中,所得溶液的浓度为1 mol·L-1
D.标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA
难度: 中等查看答案及解析
-
常温下,下列事实能说明HClO是弱电解质的是
A.NaClO、HClO都易溶于水
B.HClO与Na2SO3溶液反应,可以得到Na2SO4
C.NaClO的电离方程式:NaClO = Na+ + ClO-
D.0.01 mol·L-1 的HClO溶液pH>2
难度: 中等查看答案及解析
-
下列说法正确的是
①通过丁达尔效应可以鉴别稀豆浆和Fe(OH)3胶体
②常温时,FeCl3溶液中Fe3+与Cl-的个数之比等于1:3
③化学方程式Br2 + 2KI = 2KBr + I2说明Br的非金属性强于I
④常温时,0.1 mol·L-1 盐酸中由水电离出的c(H+)<10-7mol·L-1
A.①② B.③④ C.①③ D.②④
难度: 中等查看答案及解析
-
下列生活中的化学事例对应的离子方程式书写正确的是
A.用醋酸除去暖瓶中的水垢:2H++CaCO3== Ca2++ CO2↑+ H2O
B.利用Na2CO3溶液可除油污:CO32- + 2H2O
H2CO3 + 2OH-
C.氢氧燃料电池在酸性介质中的正极反应:O2 +4e- +2H2O = 4OH-
D.汽车用的铅蓄电池充电时阳极反应:PbSO4+2H2O-2e-== PbO2+4H++SO
难度: 中等查看答案及解析
-
在恒温恒容密闭容器中进行的合成氨反应,下列选项一定能作为达到平衡状态标志的是
A.混合气体的密度不再发生变化
B.反应过程中v(N2):v(H2)=1:3
C.反应过程中c(N2):c(H2):c(NH3)=1:3:2
D.单位时间内断开a mol H-H键的同时断开2a mol N-H键
难度: 简单查看答案及解析
-
下列说法不正确的是
A.
没有顺反异构体
B.1,3-丁二烯可以作为合成高分子化合物的原料
C.用乙醇和浓硫酸制备乙烯时,用水浴加热控制反应温度
D.常温下,将苯酚加入到少量水中有浑浊,滴入适量NaOH溶液后浑浊消失
难度: 简单查看答案及解析
-
关于苹果酸(
)说法正确的是
A.苹果酸不易溶于水而易溶于有机溶剂
B.和苹果酸具有相同官能团的同分异构体只有1种
C.1 mol苹果酸与足量NaOH溶液反应时,最多消耗3 mol NaOH
D.1mol苹果酸与足量NaHCO3溶液反应时,最多可得44.8LCO2(标准状况下)
难度: 简单查看答案及解析
-
下列叙述的理由与结论因果关系正确的是
选项
理由
结论
A
与盐酸反应时,相同物质的量的原子失去电子的数目:Al>Na
还原性:Al>Na
B
室温时,相同物质的量浓度溶液的pH:AlCl3<MgCl2
碱性:Mg(OH)2>Al(OH)3
C
相同数目的分子可电离的H+数:H2SO4>HClO4
酸性:H2SO4>HClO4
D
用饱和NaHCO3溶液可以除去CO2 中含有的少量SO2
非金属性:S > C
难度: 中等查看答案及解析
-
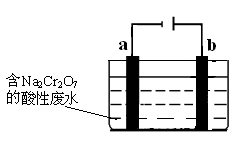
下图是模拟工业电解饱和食盐水的装置图,
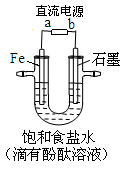
下列叙述不正确的是
A.a为电源的负极
B.Fe电极的电极反应是4OH――4e-= 2H2O+O2↑
C.通电一段时间后,铁电极附近溶液先变红
D.电解饱和食盐水的化学方程式是2NaCl + 2H2O
2NaOH + H2↑+ Cl2↑
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
M
R
原子半径/nm
0.186
0.102
0.075
0.074
0.143
主要化合价
+1
+6 -2
+5 -3
-2
+3
已知X是短周期中最活泼的金属元素,且与R同周期。下列叙述不正确的是
A.离子半径大小:Y2- > M2- > R3+
B.Z与M组成的某种化合物能形成酸雨
C.Y与M组成的化合物跟水反应后一定能得强酸
D.X、Y、R的最高价氧化物的水化物两两之间能发生反应
难度: 中等查看答案及解析
-
甲、乙两物质的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,物质的量浓度:甲=乙
B.温度变化相同时,溶解度数值的变化量:甲>乙
C.t2℃时,饱和溶液中溶质的质量分数:甲=乙
D.相同质量的饱和溶液由t2℃降到t1℃时,析出的固体:甲<乙
难度: 中等查看答案及解析
-
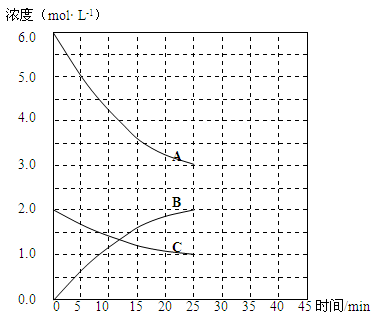
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)
4NO2 (g)+ O2(g) ΔH > 0t℃时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s
0
500
100 0
150 0
c(N2O5)/ mol·L-1
5.00
3.52
2.50
2.50
下列说法中不正确的是
A.500 s 内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.达平衡时,N2O5的转化率为50%
C.达平衡后,升高温度平衡常数减小
D.达平衡后,其他条件不变,将容器的体积压缩到原来的一半,c(N2O5)> 5.00 mol·L-1
难度: 中等查看答案及解析
-
下列选项中的原因或结论与现象不对应的是
选项
现象
原因或结论
A
在 H2O2中加入MnO2,能加速H2O2的分解速率
MnO2降低了反应所需的活化能
B
向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1KSCN溶液,溶液颜色加深
增大反应物浓度,平衡向正反应方向移动
C
将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深
该反应△H<0,平衡向生成NO2方向移动
D
在密闭容器中有反应:A+xB(g)
2C(g)。达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的两倍,测得c(A)为0.4mol/L-1
A非气体、x=1
难度: 中等查看答案及解析
-
常温下,下列溶液中的粒子浓度关系正确的是
A.NH4Cl溶液中:c(Cl-)=c(NH4+) >c(OH-)=c(H+)
B.Na2SO4溶液中:c(Na+)+ c(H+)=c(SO42-) + c(OH-)
C.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)
D.浓度均为0.1mol·L-1CH3COOH与CH3COONa溶液等体积混合:2c(H+)-2c(OH-)=c (CH3COO-)-c(CH3COOH)
难度: 中等查看答案及解析