-
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H =" -92" kJ·mol-1
2NH3(g) △H =" -92" kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
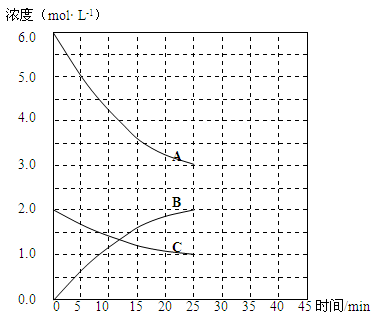
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:

① 表示N2的浓度变化的曲线是________(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是________。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = ________(计算结果可用分数表示)。
若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
-
(9分)合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
T1℃时,在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示:
请回答:
(1)若反应起始时n(N2)为1mol、n(H2)为3mol,则反应达到平衡时,放出的热量 (填“=”或“<”或“>”)92 kJ
(2)表示N2 浓度变化的曲线是 (填浓度变化曲线代号“A”或“B”或“C”)。
(3)用H2 浓度的变化表示该反应在0~25min末的速率是 mol·L-1·min-1。
(4)若该反应在一定条件下于25 min末达到平衡状态,则
①此时平衡常数K = 。
②保持该反应条件不变至第30 min末,将温度由T1℃升高到T2℃,则反应在第40min末再次达到平衡,在此过程中H2浓度变化了1.5 mol·L-1,请在图中画出从第25 min末 ~ 45min末NH3浓度的变化曲线。
-
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
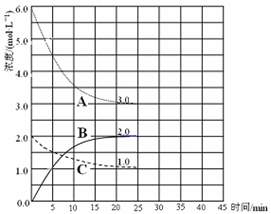
① 表示N2 的浓度变化的曲线是________(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2 的浓度变化表示的化学反应平均速率是________。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = ________(计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______________(填“增大”、“减小”或“不变”)。
(3)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2 浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(4)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________________mol。
-
合成氨对农业生产及国防建设均具有重要意义.
N2(g)+3H2(g)⇌2NH3(g)△H=-92kJ•mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是________(填序号).
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2的物质的量浓度不再发生变化
d.单位时间内断开a个H-H键的同时形成3a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
f. NH3的生成速率与H2的消耗速率之比为2:3
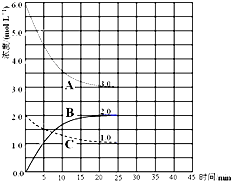
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如图所示.
①前25min 内,用H2 的浓度变化表示的化学反应平均速率是________.
②在25min 末反应刚好达到平衡,则该温度下反应的平衡常数K=________(计算结果保留两位小数),达到平衡时,H2的转化率α=________.若升高温度,该反应的平衡常数值将________(填“增大”、“减小”或“不变”).
(3)下列措施中能使n(H2)/n(NH3)增大的有________.
A.升高温度 B.加入催化剂 C.将N2(g)从体系中分离
D.再充入1molN2和3mol H2E.体积不变,充入He(g),使体系总压强增大.
-
(14分)合成氨对工、农业生产和国防都有重要意义。
已知:N2(g)+3H2(g) 2NH3(g);△H= -92.4 kJ·mol-1,请回答:
2NH3(g);△H= -92.4 kJ·mol-1,请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是_____(填字母)。
a.用铁触媒(催化剂)加快化学反应速率
b.采用较高压强(20 MPa~50 MPa)
c.将原料气中的少量CO等气体净化除去
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积V恒定,达到平衡时,气体的压强为原来的 ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2__а1(填“>、<或=”)。
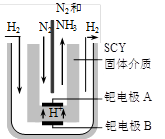
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。钯电极A是电解池的____极(填“阳”或 “阴”),该极上的电极反应式是________。
-
Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
(1)在恒温恒容密闭容器中进行的合成氨反应,N2(g)+3H2(g)⇌2NH3(g),下列能表示达到平衡状态的是______(填序号).
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
Ⅱ、能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.以CH4和H2O为原料,通过下列反应来制备甲醇.
(1)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g),测得在一定的压强下CH4的转化率与温度的关系如图.
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为______;
②100℃时反应的平衡常数为______.
(2)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应CO(g)+2H2(g)⇌CH3OH (g)生成甲醇,平衡后将容器的容积压缩到原来的 ,其他条件不变,对平衡体系产生的影响是______(填字母序号).
,其他条件不变,对平衡体系产生的影响是______(填字母序号).
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时c(H2)/c(CH3OH)减小
E.平衡常数K增大
(3)已知:反应:4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)△H=-116kJ/mol,H2(g)+Cl2(g)═2HCl(g)△H=-184kJ/mol
Ⅱ.
请回答:
①H2与O2反应生成气态水的热化学方程式是______.
②断开1mol H-O 键所需能量约为______kJ.

-
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:
N2(g)+3H2(g)⇌2NH3(g) △H=-92.4KJ/mol,
(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如下表:
| 不同时间各物质的物质的量/mol |
| 0min | 1min | 2min | 3min | 4min |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
| | | | | |
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_____________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向___________(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是__________(选填序号)
A.N2的转化率等于NH3的产率
B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变
D.混合气体的密度不变
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是__________。
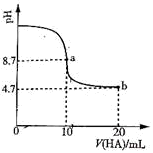
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)= c(A-)+ c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L
-
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号) 。
-
硝酸铵在工农业生产和国防中占有极为重要的位置,下面的流程图是硝酸铵的工业生产工艺过程.

根据图回答下列问题:(1)已知N2(g)+3H2(g)⇌2NH3(g)△H=-92.4 kJ/mol.请回答:①在500℃、1.01×105 kPa和铁催化条件下向一密闭容器中充入1 mol N2和3 mol H2,充分反应后,放出的热量小于92.4 kJ,理由:②为有效提高氢气的转化率,实际生产中宜采取的措施有.A.降低压强B.最适合催化剂活性的适当高温C.增大压强D.及时移出氨E.循环利用和不断补充氮气(2)氨催化氧化的化学方程式为4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H<0.
该反应的化学平衡常数表达式K=______,当温度升高时,K值______(填“增大”“减小”或“无影响”).
-
氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+3H2(g) 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
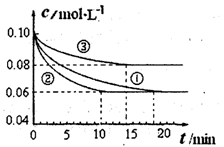
实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为________。与实验①相比,.实验②所采用的实验条件可能为________(填字母),实验③所采用的实验条件可能为________(填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是________(填字母)
2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是________(填字母)
a.升高温度 b.增大压强 c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到________(填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为________。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a________b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为________。
2NH3(g) △H = -92 kJ·mol-1










