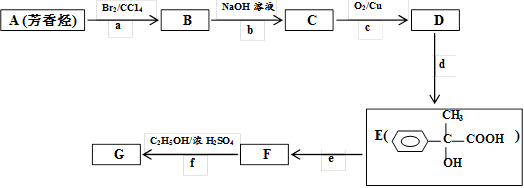
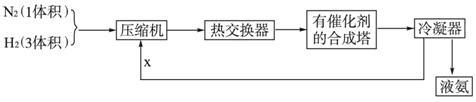
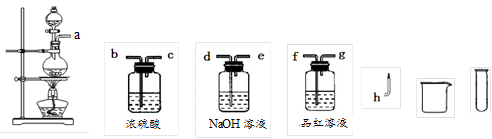
-
2010年11月,在墨西哥坎昆举行了全球环境气候会议,我国近年在节能减排方面取得的成就受到了肯定。下列减排的气体中,造成地球温室效应的主要气体是
A.二氧化碳 B.二氧化硫 C.氮氧化物 D.含铅废气
难度: 中等查看答案及解析
-
下图所示的实验方法、装置或操作完全正确的是
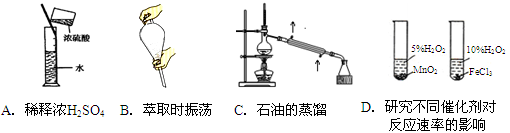
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,11.2 L氨气中含有的氢原子数为1.5NA
B.标准状况下,0.2 mol三氧化硫中含有的氧原子数为0.6NA
C.常温下,7.1 g氯气与足量的氢氧化钠溶液反应,转移的电子数为0.2NA
D.常温下, 1 L 0.1 mol/L AlCl3溶液中含Al3+数为0.1NA
难度: 中等查看答案及解析
-
下列反应可以发生且符合 “强酸制弱酸”规律的是
A.CuSO4+H2S=CuS↓+H2SO4
B.CO2+H2O+(CH3COO)2Ca=2CH3COOH+CaCO3↓
C.2NaCl+H2SO4(浓)====Na2SO4+2HCl↑
D.Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
难度: 中等查看答案及解析
-
下列说法中,错误的是
A.NaHCO3溶液中碳元素主要以HCO3—存在
B.Na2CO3溶液中滴加酚酞呈红色,加热红色变深
C.NH4Cl溶液呈酸性这一事实能说明一水合氨为弱碱
D.在稀醋酸中加醋酸钠固体能促进醋酸的电离
难度: 中等查看答案及解析
-
锌与稀硝酸反应,若被氧化的锌与被还原的硝酸的物质的量之比为2:1,则该反应的还原产物为
A.NO B.N2O C.NO2 D.Zn(NO3)2
难度: 中等查看答案及解析
-
下列化学用语书写正确的是
A.乙醇的结构简式:C2H6O B.HCl的电子式:
C.硫离子的结构示意图
D.乙烷的分子式:CH3—CH3
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是
A.硫化氢气体通入足量氢氧化钠溶液中:H2S+2OH—=S2—+2H2O
B.铁与足量稀硝酸反应:Fe+2H+=Fe2++H2↑
C.氯化铁溶液与浓氨水反应:Fe3++3OH—=Fe(OH)3↓
D.Al2O3溶于盐酸:Al2O3+6H+ =2Al3++3H2O
难度: 中等查看答案及解析
-
下列有关元素或物质性质的说法正确的是
A.元素的最高正化合价在数值上一定等于它所在的族序数
B.同周期主族元素的原子半径越小,越难失去电子
C.元素的非金属性越强,它的气态氢化物的沸点越高
D.酸性:HClO4>H2SO4>H3PO4>H2SiO3
难度: 中等查看答案及解析
-
下列有机物能与溴发生加成反应的是
A.苯 B.乙酸 C.丙烯 D.聚乙烯
难度: 中等查看答案及解析
-
一定温度下,氢氧化镁的悬浊液中存在下列平衡:Mg(OH)2(s)
Mg2+(aq)+2OH—(aq),保持温度不变,向其中加入下列物质,可使悬浊液中氢氧化镁固体质量减少的是
A.H2O B.MgCl2固体 C.NaOH 固体 D.NH4C1固体
难度: 中等查看答案及解析
-
下列化合物不能由两种单质直接化合生成的是
A.FeC12 B.CuC12 C.FeS D.P2O5
难度: 中等查看答案及解析