-
下列说法不正确的是( )
A.H2S、H2O、HF的热稳定性依次增强
B.相同条件下,H2S的沸点比H2O高
C.在过渡元素中寻找优良的催化剂
D.在周期表中金属元素与非金属元素交界处寻找半导体材料
难度: 简单查看答案及解析
-
在短周期中X、Y可组成XY3,下列叙述正确的是( )
A.若Y的原子序数为m,则X的原子序数必为m+4
B.XY3一定是离子化合物
C.X、Y可属两个不同周期,也可属于同一周期
D.X原子半径一定大于Y的原子半径
难度: 简单查看答案及解析
-
X、Y、Z、W为四种短周期元素,已知X、Z同主族,Y2+、Z—、W+三种离子的电子层结构与氖原子相同,下列正确的是( )
A.气态氢化物的稳定性:HX>HZ
B.原子半径:W > Y > Z > X
C.阴离子的还原性:X— > Z—
D.金属性:Y>W
难度: 简单查看答案及解析
-
下列图示表示的是吸热反应的是( )


难度: 简单查看答案及解析
-
下列关于化学键的说法正确的是( )
A.组成单质的分子内一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子中
D.不同元素组成的多原子分子里的化学键一定为极性键
难度: 简单查看答案及解析
-
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A.NH4Cl=NH3↑+ HCl↑ B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O D.2Na2O2+2CO2=2Na2CO3+O2
难度: 简单查看答案及解析
-
在25 ℃,101 kPa下,1 mol的白磷(化学式为P4)完全燃烧放出的热量比4 mol的红磷(化学式为P)完全燃烧放出的热量多。反应方程式分别为:
P4(s)+5O2(g)=P4O10(s)
4P(s)+5O2(g)=P4O10(s)
由此判断,下列说法正确的是( )
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
难度: 简单查看答案及解析
-
已知1molH2(g)与1molBr2(l)完全反应生成2molHBr(g)放出72kJ的能量,方程式为:H2(g)+Br2(l)=2HBr(g);又知蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
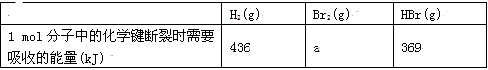
则表中a为
A.404 B.260 C.230 D.200
难度: 简单查看答案及解析
-
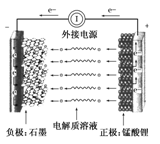
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,当①②相连时,外电路电流从②流向①;当①③相连时,溶液中的H+向③移动;当②④相连时,②上有气泡逸出;当③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④ B.③④②① C.①③④② D.③①②④
难度: 中等查看答案及解析
-
某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光。下列有关该电池的说法正确的是( )
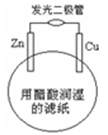
A.铜片上的电极反应:Cu2++2e﹣=Cu
B.电子通过溶液由锌片流向铜片
C.电池工作时电能直接转化为化学能
D.该电池工作时,若有16.25gZn被溶解,导线中转移0.50mol电子
难度: 中等查看答案及解析
-
下图装置可用来监测空气中NO的含量,下列说法正确的是( )
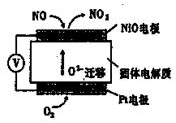
A.电子由Pt电极流出,经外电路流向NiO电极
B.Pt电极上发生的是氧化反应
C.NiO电极的电极反应式为NO+O2——2e— = NO2
D.Pt电极的电极反应式为O2+4e—+2H2O = 4OH—
难度: 困难查看答案及解析
-
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点.其中一种镁原电池的反应为xMg+Mo3S4
MgxMo3S4;在镁原电池放电时,下列说法错误的是( )
A.Mg2+向正极迁移 B.正极反应为:Mo3S4+2xe-===Mo3S42x-
C.Mo3S4发生氧化反应 D.负极反应为:xMg-2xe-===xMg2+
难度: 简单查看答案及解析
-
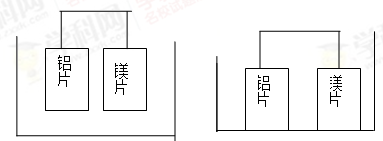
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
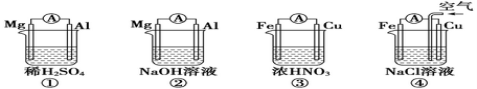
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为:2H2O+2e-= 2OH-+H2↑
C.③中Fe作负极,电极反应式为Fe-2e-= Fe2+
D.④中Cu作正极,电极反应式为2H++2e-= H2↑
难度: 简单查看答案及解析
-
干电池原理示意图如下,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是
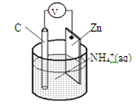
A.碳为电池的正极
B.Zn极上发生还原反应
C.Zn2+移向该电池的负极
D.反应2NH4++2e-=2NH3↑+H2↑在负极上发生
难度: 困难查看答案及解析
-
甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下。下列说法正确的是( )
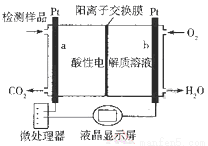
A.该装置为电能转化为化学能的装置
B.a电极发生的电极反应为CH3OH + H2O - 6e- ═ CO2↑ + 6H+
C.当电路中有1 mol e-转移时,正极区n(H+)增加1 mol
D.将酸性电解质溶液改为碱性电解质溶液该测试仪不可能产生电流
难度: 极难查看答案及解析