-
下列关于有机物的说法正确是( )
A.乙烯、氯乙烯都属于不饱和烃
B.油脂、蛋白质都能发生水解反应
C.乙酸、乙酸乙酯都不能与金属Na反应
D.苯不与任何酸反应难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.3.4gNH3中含N-H键数目为0.2NA
B.27g Al在22.4L Cl2中燃烧,转移的电子总数为3 NA
C.0.5mol•L-1CuCl2溶液中含Cl-数为NA
D.84 g NaHCO3与MgCO3的混合物中所含氧原子数目为3NA难度: 中等查看答案及解析
-
表为元素周期表的一部分,有关短周期X、Y、Z、R四种元素叙述正确的是( )
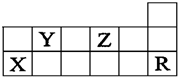
A.热稳定性:Y的气态氢化物<Z的气态氢化物
B.原子半径:r(X)<r(Y)<r(Z)
C.Y和Z的最高价氧化物对应水化物均为强酸
D.R原子的结构示意图为:难度: 中等查看答案及解析
-
在氧化还原反应的过程中,氧化反应和还原反应同时发生,有关SO2-2e-+2H2O→SO42-+4H+反应的说法错误的是( )
A.该反应为氧化反应
B.上述反应中若产生0.1 mol SO42-,则消耗SO2的物质的量为0.1mol
C.Fe2(SO4)3、品红两种溶液都能使上述反应进行
D.通入Cl2会降低SO2的漂白作用难度: 中等查看答案及解析
-
室温下,下列有关溶液的说法正确的是( )
A.等体积pH=3的醋酸溶液和pH=11的碱溶液混合,混合后溶液pH一定为7
B.中和等体积、等浓度醋酸溶液和盐酸溶液,所需NaOH的量不同
C.浓度为0.1 mol•L-1 Na2CO3溶液中:c (CO32-)>c (HCO3-)
D.0.1 mol•L-1醋酸溶液中由水电离的c(H+)=10-13 mol•L-1难度: 中等查看答案及解析
-
H2C2O4可使酸性KMnO4溶液褪色(Mn2+可作该反应的催化剂),依据褪色时间的长短可比较反应进行的快慢.下列实验中溶液褪色最快的一组是( )
组号 反应温度/℃ 参加反应物质 KMnO4 H2C2O4 MnSO4 V/mL c/mol•L-1 V/mL c/mol•L-1 m/g A 20 4 0.1 1 0.1 B 20 4 0.1 2 0.1 C 40 4 0.1 2 0.1 D 40 4 0.1 2 0.1 0.1
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( )
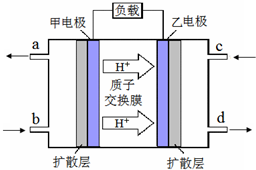
A.H+从正极区通过交换膜移向负极区
B.负极的电极反应式为:CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+
C.d导出的是CO2
D.图中b、c分别是O2、甲醇难度: 中等查看答案及解析
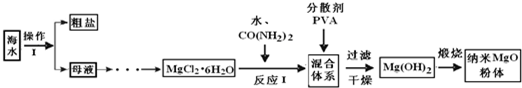

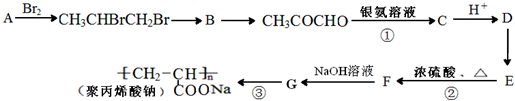
 )是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如下:
)是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如下: