-
下列物质中,不属于电解质的是
A.铁 B.硝酸 C.氯化钠 D.氢氧化钾
难度: 简单查看答案及解析
-
在铜一锌一硫酸构成的原电池中,当导线中有1mol电子通过时,理论上的两极变化是
A.锌片增重32.5g B.锌片溶解32.5g
C.铜片上析出2gH2 D.铜片上析出1mol H2
难度: 简单查看答案及解析
-
下列溶液,按
由小到大顺序排列的是
①
溶液 ②
溶液
③
溶液 ④
溶液
A. ①②④③ B. ②①④③ C. ③④①② D. ④③②①
难度: 简单查看答案及解析
-
室温时,柠檬水溶液的pH是3,其中的c(OH-)是
A.0.1 mol/L B.1×10-11 mol/L C.1×10-7 mol/L D.1×10-3 mol/L
难度: 简单查看答案及解析
-
下列酸溶液的pH相同时,其物质的量浓度最小的是
A.H2SO4 B.H2SO3 C.CH3COOH D.HNO3
难度: 简单查看答案及解析
-
下列说法正确的是
A.盐溶液都是中性的 B.盐溶液的酸碱性与盐的类型无关
C.NaHCO3溶液显酸性 D.Na2CO3溶液显碱性,是因为溶液中c(OH-)>c(H+)
难度: 简单查看答案及解析
-
MOH强碱溶液和等体积等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
A.c(M+)>c(OH-)>c(A-)>c(H+) B.c(M+)> c(A-) > c(H+)> c(OH-)
C.c(M+)> c(A-) > c(OH-) >c(H+) D.c(M+)> c(H+) >c(A-)> c(OH-)
难度: 简单查看答案及解析
-
关于右图所示的原电池,下列说法不正确的是
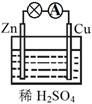
A.Cu为正极,Zn为负极
B.该装置能将化学能转化为电能
C.电子由铜片通过导线流向锌片
D.正极反应为 2H+ + 2e-
H2↑
难度: 简单查看答案及解析
-
下列方程式中,属于水解反应的是
A.H2O + H2O
H3O+ + OH— B.HCO3— + OH— = H2O + CO32—
C.CO2 + H2O
H2CO3 D.CO32— + H2O
HCO3— + OH—
难度: 简单查看答案及解析
-
下列操作中,能使电离平衡H2O
H++OH-,向右移动且溶液呈酸性的是
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=6
难度: 简单查看答案及解析
-
下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是:
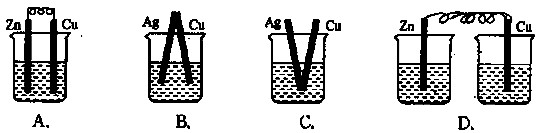
难度: 简单查看答案及解析
-
为了除去MgCl2溶液中的Fe3+,可在加热搅拌的条件下加入的一种试剂是
A.NaOH B.Na2CO3 C.氨水 D.MgO
难度: 简单查看答案及解析
-
将0.1 mol/L醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c(OH-)都减小 B.水的离子积不变
C.醋酸电离平衡向左移动 D.溶液中c(H+)增大
难度: 简单查看答案及解析
-
下列化学用语书写正确的是
A.乙烯的结构式:C2H4
B.氮气分子的电子式:
C.NaCl的电子式:
D. 碳酸氢钠溶于水的电离方程式:NaHCO3=Na++HCO3-
难度: 简单查看答案及解析
-
要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,
已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物
PbSO4
PbCO3
PbS
溶解度/g
1.03×10-4
1.81×10-7
1.84×10-14
由上述数据可知,选用的沉淀剂最好为
A.硫化物 B.硫酸盐 C.碳酸盐 D.以上沉淀剂均可
难度: 简单查看答案及解析
-
物质的量浓度相同的三种一元酸的钠盐NaX、NaY、NaZ溶液的pH 分别为8、9、10,则这三种一元酸的酸性由强到弱的顺序为
A. HX>HY>HZ B. HX>HZ>HY
C. HZ>HY>HX D. HY >HX>HZ
难度: 简单查看答案及解析
-
某原电池装置如右图所示。下列有关叙述中,正确的是
A.Fe作正极,发生氧化反应
B.负极反应: 2H+ + 2e-=H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
难度: 简单查看答案及解析
-
将AgCl分别加入盛有:①5 mL水;② 6 mL 0.5 mol/L NaCl溶液;③10 mL 0.2 mol/L CaCl2溶液;④50 mL 0.1 mol/L 盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
A.④③②① B.②③④① C.①④③② D.①③②④
难度: 简单查看答案及解析
-
碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:
Zn + 2MnO2 + 2 H2O = Zn(OH)2 + 2MnOOH
在此电池放电时,正极(碳棒)上发生反应的物质是
A、Zn B、碳棒 C、MnO2 D、MnO2和H2O
难度: 简单查看答案及解析
-
下列根据反应原理设计的应用,不正确的是
A.CO32—+H2O
HCO3—+OH- 热的纯碱溶液清洗油污
B.Al3++3H2O
Al(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)
TiO2·xH2O+4HCl 用TiCl4制备TiO2
D.SnCl2+H2O
Sn(OH)Cl+HCl 配制氯化亚锡溶液时加入氢氧化钠
难度: 简单查看答案及解析
-
常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中
A.c(NH4+)<c(Cl-) B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-) D.无法确定c(NH4+)与c(Cl-)的关系
难度: 简单查看答案及解析
-
下列叙述正确的是:
A.0.1 mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
难度: 简单查看答案及解析
-
以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2 ,根据上述实验事实可推知MnS具有的相关性质是
A.具有吸附性 B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
难度: 简单查看答案及解析
-
用pH试纸测定溶液pH的正确操作是
A. 将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B. 将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测点在试纸上,再与标准比色卡对照
C. 将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D. 将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
难度: 简单查看答案及解析
-
在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、CO32- ② K+、Fe3+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
C. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中
增大
难度: 简单查看答案及解析
-
下列说法正确的是
A.向0.1 mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO3—、Cl-、CO32—、Na+可大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
难度: 简单查看答案及解析
-
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-===CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
难度: 简单查看答案及解析
-
下列有关0.1 mol•L-1NaHCO3溶液中离子浓度的关系式,正确的是
A.c (Na+) > c(HCO3-) > c(CO32-) > c(H+) > c(OH-)
B.c(Na+) > c(CO32-) > c(HCO3-) > c(OH-) > c(H+)
C.c(Na+) + c(H+) = c(HCO3-) + 2c(CO32-) + c(OH-)
D.c(Na+) = c(HCO3-) + 2c(CO32-) + c(H2CO3)
难度: 简单查看答案及解析
-
对于常温下pH=1的硝酸溶液,有关叙述:
① 该溶液1 mL稀释至100 mL后, pH=3
② 向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③ 该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为
④ 向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
难度: 简单查看答案及解析
