-
下列设备工作时,将化学能转化为电能的是( )
A
B
C
D



硅太阳能电池
锂离子电池
太阳能集热器
燃气灶
难度: 简单查看答案及解析
-
在离子RO3n-中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是( ) A.A-x+n+48 B.A-x+n+24 C.A-x-n-24 D.A+x-n-24
难度: 中等查看答案及解析
-
元素A的阳离子aAm+与元素B的阴离子bBn-具有相同的电子层结构。以下关于A、B元素性质的比较中,正确的是 ( )
①原子序数:A>B ②离子半径:aAm+<bBn- ③原子半径:A<B ④元素所在的周期序数:A>B ⑤A的最高正价与B的最低负价的绝对值相等 ⑥b=a+m-n
A.②③④ B.①②④ C.④⑤⑥ D.②⑤⑥
难度: 中等查看答案及解析
-
下列反应可用于设计原电池的是( )[
A.CO2+2H2O→CH4+2O2 B.NaOH+HCl = NaCl+H2O
C.Cu+2HCl = Cu Cl2+H2↑ D.4Al+3O2+6H2O = 4Al(OH)3
难度: 中等查看答案及解析
-
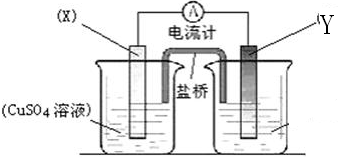
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。该电池工作时,有关说法正确的是( )
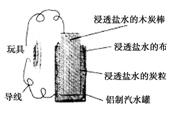
A.铝罐将逐渐被腐蚀
B.炭粒和炭棒上发生的反应为:O2+4e-===2O2-
C.炭棒应与玩具电机的负极相连
D.该电池工作一段时间后炭棒和炭粒的质量会减轻
难度: 中等查看答案及解析
-
A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由C经导线流向D;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,B极发生氧化反应。据此,判断四种金属的活动性顺序是( )
A.A>B>D>C B. A>C>D>B C.C>A>B>D D.B>D>C>A
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依
次增大,X原子最外层有7个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列叙述正确的是( )
A.Y的离子半径比X的离子半径大
B.化合物
Y2Z中既有离子键、又有共价键
C.Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝
D.简单气态氢化物的稳定性由强到弱的顺序:Z、W、X
难度: 中等查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
难度: 中等查看答案及解析
-
下列说法中有明显错误的是( )
A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞就是有效碰撞
D.加入适宜催化剂,可使活化分子百分数大大增加,从而成千上万倍地增大化学反应的速率
难度: 中等查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A.v(A)=0.15mol/(L•min) B.v(B)=0.04mol/(L•s)
C.v(C)=0.03mol/(L•s) D.v(D)=0.4mol/(L•min)
难度: 中等查看答案及解析
-
把180mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了加快反应速率而不影响生成H2的总量,下列措施可行的是( )
A.改用20mL 18mol/L的H2SO4实验 B.反应
物中加入少
量的硝酸钠固体
C.反应
物中加入少量的硫酸铜固体 D.反应
物中加入少量的碳酸钠固体
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(正反应吸
热),下列图象中正确的是[( )
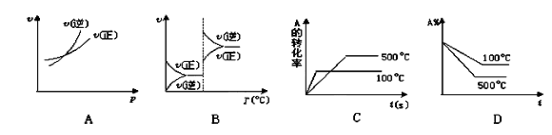
难度: 中等查看答案及解析
-
下面关于化学反应的限度的叙述中,正确的是( )
A.化学反应的限度都相同
B.可以通过改变温度控制化学反应的限度
C.可以通过延长化学反应的时间改变化学反应的限度
D.当一个化学反应在一定条件下达到限度时,反应即停止
难度: 中等查看答案及解析
-
在一定温度下的定容容器中,发生反应:2A(g)+B(s)
C(g)+D(g),下列描述中
能表明反应已达到平衡状态的是( )
①混合气体的压强不变 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④C(g)的物质的量浓度不变 ⑤容器内A、C、D三种
气体的浓度之比为2:1:1 ⑥单位时间内生成n molD,同时生成2n mol A ⑦单位时间内生成n molC,同时生成n mol D
A.①②③ B.②③④⑥ C.②③⑤⑥⑦ D.①③⑤⑦
难度: 中等查看答案及解析
-
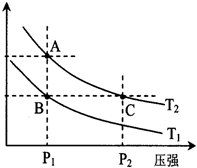
恒温、恒压下,a molA和b molB在一个容积可变的容器中发生如下反应:A(g)+2B(g)
2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是( )
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平
衡后容器中的压强比为(a+b)∶(a+b-
)
C.若起始时放入2a molA和2b molB,则达平衡时生成2n molC
D.当v正(A)=2v逆(B)时,可确定反应达平衡
难度: 中等查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )
A.c1∶c2=3∶1 B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率相等 D.c1的取值范围为0 mol/L≦c1≦0.14 mol/L
难度: 中等查看答案及解析
-
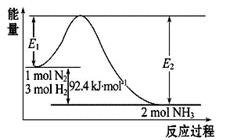
高铁电池是电动汽车首选的电池之一,该电池的工作原理为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+ 2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是( )
A.高铁电池产生的电流从负极经外电路到达正极
B.正极反应式为Zn+2OH-—2e - =Zn(OH)2
C.负极pH减小,正极pH增大,电解液pH增大
D.每氧化1mol高铁酸钾转移3mol电子
难度: 中等查看答案及解析
-
有反应mA(g)+nB(g)
wC(g),测得在同一时间内A每分钟减少0.15 mol·L- 1, B每分钟减少0.05 mol·L-1,C每分钟增加0.1 mol·L- 1,则下列叙述不正确的是( )
A.m∶n∶w=3∶1∶2
B.体积和温度不变时,若在前10s内A减少了x mol,则B在前20s内减少2x/3 mol
C.体积和温度不变时,随反应进行压强逐渐下降,一段时间后压强保持恒定不变
D.单位时间内反应物浓度的减少大于生成物浓度的增加
难度: 中等查看答案及解析
-
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正
确的是( )
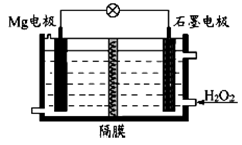
A.
Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
难度: 中等查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是 ( )
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动;②已达平衡的反应N2 (g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高[;③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动;④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )

A.①是其他条件一定时,反应速率随温度变化的图像,则正反应ΔH>0
B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C.③是在有无催化剂存在条件下,建立平衡过程的图像,b是使用催化剂时的曲线
D.④是一定条件下,向一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像
难度: 困难查看答案及解析
-
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)
N2(g)+2CO2(g),下列说法中正确的是( )
A.使用适当的催化剂只改变正反应速率
B
.降低压强能提高逆反应速率
C.升高温度能同时提高正、逆反应速率
D.减小压强对正反应速率影响小于逆反应速率的影响
难度: 中等查看答案及解析
-
下图是可逆反应A+2B
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
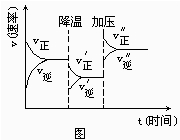
A.A、
B、C、D均为气体
B.若A、B是气体,则C、D是液体或固体
C.逆反应是放热反应
D.在整个过程中,A的转化率一直增大
难度: 困难查看答案及解析
-
在密闭容器中发生反应:aX(g)+bY(g)
cZ(g)+dW(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述不正确的是( )
A.平衡向逆反应方向移动 B.(a+b)〈 (c+d)
C.Z的物质的量浓度变小 D.X的转化率
变小
难度: 中等查看答案及解析