-
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应
来合成甲醇:2H2(g) + CO(g)  CH3OH(g) △H<0
CH3OH(g) △H<0
(1)① 要提高CO的转化率,可以采取的措施 是_____________(填序号)。
是_____________(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
② 300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响
是 (填 字母)。
字母)。
A. c(H2)减少 B.正反应速率加快 ,逆反应速率减慢
,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/ c(CH3OH)减小
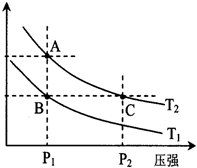
(2)下图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A_______C(填“>”、“=”或“<”,下同),B、C两点的反应速率B_________C,由状态B到状态A,可采用_________的方法(填“升温”或“降温”)。
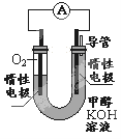
(3)氢氧燃料电池的总反应方程式为2H2+ O2=2H2O,以30%KOH溶液为电解质.其中,氢气在______(填“正”或“负”)极发生_____反应(填“氧化”或“还原”),半电极反应方程式___________________。电路中每转移0.2mol电子,标准状况下消耗O2的体积是______L 。
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1
③H2O(g)= H2O(l) ΔH=-c kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(l) ΔH= kJ·mol-1。
-
能源短缺是人类社会面临的重大问题,而“原子经济”就是反应物的原子全部转化为期望的最终产物。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则H2的转化率为________。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为________
-
开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g) CH3OH(g) △H= -90.8kJ•mol-1。
CH3OH(g) △H= -90.8kJ•mol-1。
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,以CH3OH表示该过程的反应速率v(CH3OH)=______。
②要提高反应2H2(g)+CO(g)⇌CH3OH(g)中CO的转化率,可以采取的措施是_______。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2 e.加入惰性气体 f.分离出甲醇
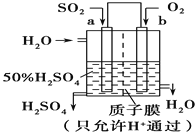
(2)①氢氧燃料电池是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)燃料电池。如果是酸性燃料电池,则正极反应方程式是____________。
②科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为__________。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)===HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:______________________________________________。
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的_________________。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)==CH3OH(g),已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
| 键能/(kJ·mol-1) | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题:
①图1中曲线a到曲线b的措施是_________。
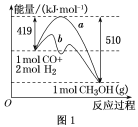
②已知CO中的C与O之间为叁键,其键能为x kJ/mol,则x=________。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为______________________________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为________。
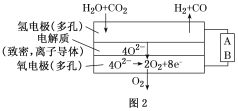
(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000 ℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由图2可知A为直流电源的________(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:____________________。
-
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)己知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),△H=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g), △H=-566.0kJ/mol
③H2O(g)=H2O(l), △H=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式__________________。
(2)某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置。

①甲池负极的电极反应为__________________。
②工作一段时间后,测得甲中溶液的pH减小,该电池总反应的离子方程式为______。
③乙池中A(石墨)电极的名称为__________________(填“正极”、“负极”或“阴极”、“阳极”),乙池中总反应式为_________。
④当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为__mL(标准状况),假设乙池、丙池中的溶液均为足量,丙池中____(填“C”或“D”)极析出______g铜。
-
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为________
(2)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①工作一段时间后,测得溶液的pH 。(填“增大”“减小”“不变”)
②该电池负极的电极反应为 。
(3)某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3 360 mL(标准状况)氧气,阴极析出金属10.4 g,在该含氧酸盐中金属的化合价为 ,
在该实验中,若不考虑能量的损失,电池中消耗甲醇的质量最少是 g(结果精确至0.1 g)
-
甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景。在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为 2H2(g)+CO(g) CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图所示。
CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图所示。
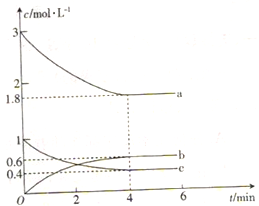
回答下列问题:
(1)代表H2浓度变化的曲线为_______(填“a”、“b”或“c”)。
(2)提出一条可以加快反应速率的措施:______________________________。
(3)0〜4 min内,CH3OH的平均反应速率为_________________。
(4)我国某高校化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
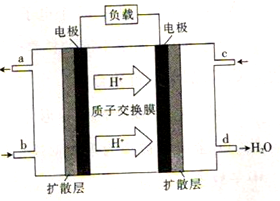
①该电池工作时,c口通入的物质为_____________,该电极为____(填“正极”或“负极”)。
②该电池工作一段时间后,,当6.4 g甲醇完全反应生成CO2时,消耗的氧气的体积为_____L(标准状况下)。
-
Ⅰ.甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为___________________________________________________。
(2)H2(g)的燃烧热为________________。
(3)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:______________;__________(写出两点即
可)。
Ⅱ.由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2===2NH3 ΔH=a kJ·mol-1。
试根据表中所列键能数据计算a的数值为:________________。
-
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ/mol
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
(1)甲醇蒸气完全燃烧的热化学反应方程式为______________。
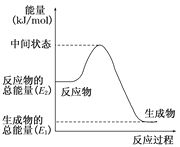
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。
(3)H2(g)的燃烧热为________。
(4)目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=﹣354.8kJ•mol﹣1
②2CO(g)+O2(g)═2CO2(g)△H2=﹣566kJ•mol﹣1
则反应2CO2(g)+4H2O(g)═2CH3OH(l)+3O2(g)△H=________.
(5)氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均为2H2+O2===2H2O。酸式电池中的电解质是酸,其负极反应可表示为2H2-4e-===4H+,则其正极反应可表示为_____________
(6)根据下式所表示的氧化还原反应设计一个原电池:2Fe3++Cu=2Fe2++Cu2+ .装置采用烧杯和盐桥,请画出原电池的装置图(标出电极材料和电解质溶液)______________________
-
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为______________________________
(2)反应②中的能量变化如图所示,该反应为 (吸或放)热反应,ΔH2=________。(用E1、E2表示)
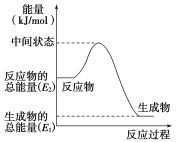
(3)H2(g)的燃烧热为________。
CH3OH(g) △H<0
是_____________(填序号)。
字母)。
,逆反应速率减慢









