-
Ⅰ.甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为___________________________________________________。
(2)H2(g)的燃烧热为________________。
(3)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:______________;__________(写出两点即
可)。
Ⅱ.由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
化学键
H—H
N—H
N≡N
键能/kJ·mol-1
436
391
945
已知反应N2+3H2===2NH3 ΔH=a kJ·mol-1。
试根据表中所列键能数据计算a的数值为:________________。
高一化学简答题中等难度题查看答案及解析
-
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ/mol
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
(1)甲醇蒸气完全燃烧的热化学反应方程式为______________。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。
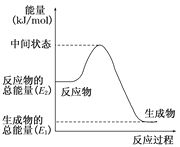
(3)H2(g)的燃烧热为________。
(4)目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=﹣354.8kJ•mol﹣1
②2CO(g)+O2(g)═2CO2(g)△H2=﹣566kJ•mol﹣1
则反应2CO2(g)+4H2O(g)═2CH3OH(l)+3O2(g)△H=________.
(5)氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均为2H2+O2===2H2O。酸式电池中的电解质是酸,其负极反应可表示为2H2-4e-===4H+,则其正极反应可表示为_____________
(6)根据下式所表示的氧化还原反应设计一个原电池:2Fe3++Cu=2Fe2++Cu2+ .装置采用烧杯和盐桥,请画出原电池的装置图(标出电极材料和电解质溶液)______________________
高一化学综合题中等难度题查看答案及解析
-
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为______________________________
(2)反应②中的能量变化如图所示,该反应为 (吸或放)热反应,ΔH2=________。(用E1、E2表示)
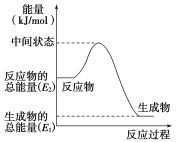
(3)H2(g)的燃烧热为________。
高一化学填空题困难题查看答案及解析
-
工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H1=-90.8 kJ/mol。
已知:2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ/mol
H2(g)+
O2(g)=H2O(g) △H3=-241.8 kJ/mol
下列有关说法正确的是
A. H2的燃烧热为241. 8 kJ/mol
B. CH3OH(g)+O2(g)=CO(g)+2H2O(g) △H=-392. 8 kJ/mol
C. “
”既表示分子个数也能表示物质的量
D. 未注明温度和压强时,△H表示标准状况下的数据
高一化学单选题中等难度题查看答案及解析
-
(6分)甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料。
已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ·mol-1
②CH4(g)+
O2(g)===CO(g)+2H2(g) ΔH2=-36 kJ·mol-1
③CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH3=+216 kJ·mol-1
(1)氢气的燃烧热为________,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式: ________________。
(2)现有1 mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应。当x=________时,反应②与③放出(或吸收)的总能量为0。若②反应过程中能量转化过程如图所示,下列有关说法中正确的是________。
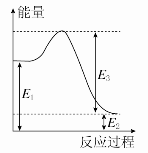
A.E1=36 kJ B.E2=36 kJ
C.E1-E2=36 kJ D.E3-E1=36 kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g) ΔH1(CO结构式为C≡O)。又知某些化学键的键能(断开1 mol化学键时所需要的最低能量)数值如下表:
化学键
C—C
C—H
H—H
C—O
C≡O
H—O
键能
(kJ·mol-1)
348
413
436
358
1072
463
则ΔH1=_______,在相应的反应条件下,将1 mol CO(g)与足量H2混合充分反应后,放出或吸收的热量 △H1。(用>,<或=填空)
高一化学填空题极难题查看答案及解析
-
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ·mol-1
②CH4(g)+
O2(g)===CO(g)+2H2(g) ΔH2=-36 kJ·mol-1
③CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH3=+216 kJ·mol-1
(1)氢气的燃烧热为________________,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________________。
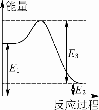
(2)现有1 mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应。当x=____________时,反应②与③放出(或吸收)的总能量为0。若②反应过程中能量转化过程如图所示,下列有关说法中正确的是________。
A.E1=36 kJ B.E2=36 kJ
C.E1-E2=36 kJ D.E3-E1=36 kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g) ΔH1(CO结构式为C≡O)。又知某些化学键的键能(断开1 mol化学键时所需要的最低能量)数值如下表:
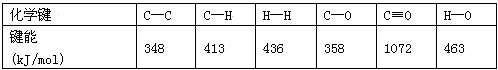
则ΔH1=____________________。
高一化学填空题困难题查看答案及解析
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)===HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:______________________________________________。
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的_________________。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)==CH3OH(g),已知某些化学键的键能数据如下表:
化学键
C—C
C—H
H—H
C—O
C≡O
O—H
键能/(kJ·mol-1)
348
413
436
358
x
463
请回答下列问题:
①图1中曲线a到曲线b的措施是_________。
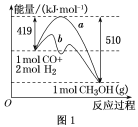
②已知CO中的C与O之间为叁键,其键能为x kJ/mol,则x=________。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为______________________________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子
Cu2+
H+
Cl-
SO42-
c/(mol·L-1)
0.5
2
2
0.5
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为________。
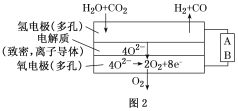
(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000 ℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由图2可知A为直流电源的________(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:____________________。
高一化学填空题中等难度题查看答案及解析
-
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为________
(2)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
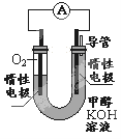
①工作一段时间后,测得溶液的pH 。(填“增大”“减小”“不变”)
②该电池负极的电极反应为 。
(3)某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3 360 mL(标准状况)氧气,阴极析出金属10.4 g,在该含氧酸盐中金属的化合价为 ,
在该实验中,若不考虑能量的损失,电池中消耗甲醇的质量最少是 g(结果精确至0.1 g)
高一化学填空题中等难度题查看答案及解析
-
“氢能”是未来最理想的新能源。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧热的热化学方程式为________(填选项字母)。
A.2H2(g)+O2(g)=2H2O(l) ΔH=-142.9 kJ·mol-1
B.H2(g)+
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2O+O2=2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+
O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O
CaO+2HBr
②2HBr+Hg
HgBr2+H2
③HgBr2+________
________+________
④2HgO
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:_____________;请根据“绿色化学”的思想评估该方法制H2的主要缺点:___________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。

请写出化学方程式:
反应①__________________________。
反应②__________________________。
高一化学填空题中等难度题查看答案及解析
-
已知:CH4(g)+2O2(g)= CO2(g)+2H2O(l)ΔH=-Q1 kJ/mol;
2H2(g)+O2(g)= 2H2O(g)ΔH =-Q2 kJ/mol ;
2H2(g)+O2(g)= 2H2O(l)ΔH =-Q3 kJ/mol。取体积比4:1的甲烷和H2的混合气112L(标况),完全燃烧后恢复到常温,放出热量为
A.4Q1+0.5Q3 B.4Q1+0.5Q2 C.4Q1+Q3 D.4Q1+2Q2
高一化学选择题中等难度题查看答案及解析