-
(6分)甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料。
已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ·mol-1
②CH4(g)+ O2(g)===CO(g)+2H2(g) ΔH2=-36 kJ·mol-1
O2(g)===CO(g)+2H2(g) ΔH2=-36 kJ·mol-1
③CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH3=+216 kJ·mol-1
(1)氢气的燃烧热为________,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式: ________________。
(2)现有1 mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应。当x=________时,反应②与③放出(或吸收)的总能量为0。若②反应过程中能量转化过程如图所示,下列有关说法中正确的是________。
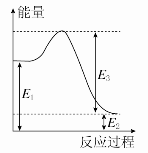
A.E1=36 kJ B.E2=36 kJ
C.E1-E2=36 kJ D.E3-E1=36 kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g) ΔH1(CO结构式为C≡O)。又知某些化学键的键能(断开1 mol化学键时所需要的最低能量)数值如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能 (kJ·mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
则ΔH1=_______,在相应的反应条件下,将1 mol CO(g)与足量H2混合充分反应后,放出或吸收的热量 △H1。(用>,<或=填空)
-
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ·mol-1
②CH4(g)+ O2(g)===CO(g)+2H2(g) ΔH2=-36 kJ·mol-1
O2(g)===CO(g)+2H2(g) ΔH2=-36 kJ·mol-1
③CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH3=+216 kJ·mol-1
(1)氢气的燃烧热为________________,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________________。
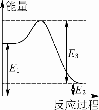
(2)现有1 mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应。当x=____________时,反应②与③放出(或吸收)的总能量为0。若②反应过程中能量转化过程如图所示,下列有关说法中正确的是________。
A.E1=36 kJ B.E2=36 kJ
C.E1-E2=36 kJ D.E3-E1=36 kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g) ΔH1(CO结构式为C≡O)。又知某些化学键的键能(断开1 mol化学键时所需要的最低能量)数值如下表:
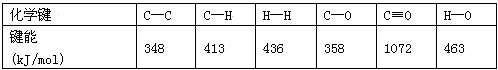
则ΔH1=____________________。
-
氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O=2H2↑+ O2↑,制得的氢气可用于制作燃料电池。试回答下列问题:
(1)分解海水时,实现了光能转化为____能。生成的氢气用于制作燃料电池时,实现了化学能转化为____能。分解海水的反应属于____反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为2H2+2O2--4e-=2H2O,则A极是电池的__极,B极电极反应式为__。
-
氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O  2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,________能转变为________能,二氧化钛作________。生成的氢气用于燃料电池时,________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应如下:
A极:2H2+2O2--4e-=2H2O
B极:O2+4e-=2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
-
(7分)氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O 2H2↑+O2↑ 。制得的氢气可用于燃料电池。试完成下列问题:
2H2↑+O2↑ 。制得的氢气可用于燃料电池。试完成下列问题:
太阳光分解海水时,实现了从_______能转化为_______能,二氧化钛作________。生成的氢气,用于燃料电池时,实现________能转化为________能。燃料电池中通入氢气的是________极(填“正”或“负”),分解海水的反应属于________反应(填“放热”或“吸热”)。
-
氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O
 2H2↑+O2↑.制得的氢气可用于燃料电池.试回答下列问题:
2H2↑+O2↑.制得的氢气可用于燃料电池.试回答下列问题:
(1)分解海水时,二氧化钛的作用是________;生成的氢气用于燃料电池时,________能转变为________能;分解海水的反应属于________反应(填“放热”或“吸热”).
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应为:
A极:H2+O2--2e-=H2O,B极:O2+4e-=2O2-.
则A极是电池的________极,电子从该极________(填“流入”或“流出”).
-
H2是一种高效而没有污染的二级能源,它可以用自然界中大量存在的水来制取:2H2O(l) 2H2(g)+O2(g),所以对氢气开发是各国研究的重要热点。你认为以下研究方向不合理的是
2H2(g)+O2(g),所以对氢气开发是各国研究的重要热点。你认为以下研究方向不合理的是
A.寻找更多的化石燃料,燃烧产生热量使水分解产生H2
B.设法将太阳光聚焦、产生高温,使水分解产生H2
C.寻找高效合适的催化剂、在较容易的条件下使水分解产生H2
D.寻找特殊的化学物质,用于开发廉价能源,以分解水制取H2
-
某研究所研制的氢氧燃料电池,可同时提供电和水。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2 + O2= 2H2O,则下列推断正确的是
A. 正极反应为O2 + 4H+ + 4e- = 2H2O
B. 该电池可在常温或高温时进行工作,对环境具有较强的适应性
C. 该电池供应36g水,同时转移2 mol电子
D. 负极反应为2H2+2CO32--4e-=2H2O+2CO2
-
燃料电池是燃料(如氢气、甲烷、一氧化碳等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法正确的是( )
A. 负极反应式:O2+2H2O+4e- 4OH-
4OH-
B. 负极反应式:CH4+8OH--8e- CO2+6H2O
CO2+6H2O
C. 随着放电的进行,溶液中氢氧根离子的浓度不变
D. 放电时溶液中的阴离子向负极移动
-
燃料电池是一种高效环境友好的发电装置。下列说法不正确的是
A. 氢氧燃料电池的总反应为2H2 + O2 = 2H2O
B. 氢氧燃料电池中,当转移4 mol电子时消耗2 mol氢气
C. 甲烷燃料电池中,通入氧气的一极为负极
D. 燃料电池中发生的化学反应是氧化还原反应
O2(g)===CO(g)+2H2(g) ΔH2=-36 kJ·mol-1



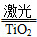 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题: