-
合成氨工业的核心反应是:N2(g)+3H2(g)  2NH3(g) ΔH= Q kJ·mol-1,能量变化如图所示,回答
2NH3(g) ΔH= Q kJ·mol-1,能量变化如图所示,回答 下列问题:
下列问题:
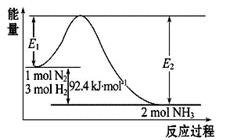
(1)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量 46.2kJ(填“<”、“>”或“=”)。
(2)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________(填“增大”、“减小”、“不变”,下同); E2- E1 。若升高温度,平衡向______反应方向移动(填“正”或“逆”),E2- E1 (填“增大”、“减小”、“不变”) 。
(3)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol ,H2为0.30
,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2的转化率________。
mol,NH3为0.10 mol。计算该条件下达到平衡时H2的转化率________。
(4)在上述(3)反应条件的密闭容器中欲提高合成氨中H2的转化率,下列措施可行的_ _(填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨气
-
(14分)I.在500 ℃、2×107 Pa和催化剂条件下合成氨工业的核心反应是:N2(g)+3H2(g) 2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
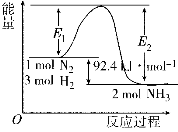
(1)在500 ℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_____(填“<”“>”或“=”)46.2 kJ,理由是_____________。
(2)将一定量的H2(g)和N2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。则该条件下达到平衡时H2的转化率为________。该温度下的平衡常数K的值为________。若升高温度,K值________(填“增大”“减小”或“不变”)。
II.一定条件下,某容积为1L的密闭容器中发生如下反应:C(s) + H2O(g) CO(g) + H2(g)
CO(g) + H2(g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均分子量为M,则M的范围为 。
(2)在(1)中若起始时充入的是2.5 molCO(g)和4molH2(g),达到平衡后混合气体的平均相对分子质量为 。
-
工业合成氨的反应(N2+3H3═2NH3)是一个放热反应.
(1)相同条件下,1mol N2和3mol H2所具有的能量______(填“>”、“<”或“=”)2mol NH3具有的能量;在相同条件下,若断开1mol N2、3mol H2和2mol NH3中的化学键时,吸收的能量分别为Q1、Q2、Q3,则Q1+Q2______Q3(填“>”、“<”或“=”);在一定条件下,当该反应生成2molNH3时,放出92kJ的热量,该条件下,如果将1mol N2和3mol H2混合,使其充分反应,放出的热量______92kJ(填“>”、“<”或“=”).
(2)实验室模拟工业合成氨时,向密闭容器内充入10mol N2、30mol H2,在一定条件下发生反应.
①若密闭容器的体积为2L,反应经过10min后,测得容器内的NH3为10mol,则用N2表示的该反应速率为______,此时容器内H2的浓度为______.
②若保持容器的容积不变,反应一段时间后,测得容器内下列各项性质保持不变.其中不能说明合成氨反应已经达到化学平衡状态的是______.
a.压强 b.密度 c.分子数 d.气体体积 e. 气体质量 f.NH3的物质的量的分数.
-
工业合成氨反应:N2+3H2⇌2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可______(填“吸收”或“放出”)热量______kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是__________。
(3)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是_______。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
-
工业合成氨的反应:N2+3H22NH3反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成2 mol NH3可________(填“吸收”或“放出”)热量________kJ。
0(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述(1)中的数值,其原因是________________________________________________________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的恒容密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________(填字母代号)。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.该条件下,N2的转化率达到最大值
d.N2和H2的浓度相等
e.该条件下,反应达到最大限度
-
工业合成氨的反应:N2(g)+3H2(g)  2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N
2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N N键放出的能量分别为436KJ、391KJ、946KJ。则:
N键放出的能量分别为436KJ、391KJ、946KJ。则:
(1)若1mol N2完全反应生成NH3可______(填“吸收”或“放出)热量_____KJ。
(2)如果将1mol N2 和 3mol H2混合,在一定条件下使其充分反应,反应放出的热量总小于上述数值,其原因是_____________________________________________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则用N2表示的化学反应速率是________mol·L -1·min-1。
(4)一定条件下,当成合成氨反应达到化学平衡时,下列说法正确的是(____)
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d. N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
-
工业合成氨反应:N2+3H2  2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可___(填“吸收”或“放出”)热量___kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是_______________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为_____mol/(L·min)。
(4)一定条件下,当合成氨反应达到化学平衡时,下列说法正确的是________
A.正反应速率和逆反应速率相等 B.正反应速率最大,逆反应速率为0
C.N2的转化率达到最大值 D.N2和H2的浓度相等
E.N2、H2和NH3的体积分数相等 F.反应达到最大限度
-
工业合成氨的原理为N2(g)+3H2(g) 2NH3(g),请回答下列问题:
2NH3(g),请回答下列问题:
(1)已知拆开1mol H﹣H键、1mol N≡N、1mol N﹣H键分别需要吸收的能量为436kJ、946kJ、391kJ。则由N2和H2反应生成1mol NH3需要放出_________的热量。
(2)若N2、H2、NH3的起始浓度依次为0.2mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,浓度分别是a、b、c(mol/L),则各物质的浓度有可能的是___________。
A.c=0.5mol/L B.b=0.5mol/L
C.c=0.4mol/L D.a=0.3mol/L
(3)若在2L密闭容器中,充入1 mol N2和3mol H2,2min时达到平衡。测得平衡时N2的浓度为0.3 mol/L。
①2min内v(NH3)=___________。
②平衡时容器的压强与起始时压强之比___________。
-
工业合成氨的反应N2+3H2===2NH3的能量变化如图所示,请回答有关问题:
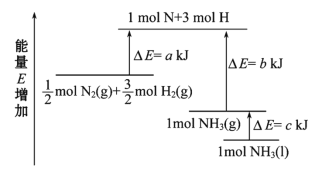
(1)合成1 mol NH3(l)________(填“吸收”或“放出”)________ kJ的热量。
(2)已知:拆开 1 mol H—H键、1 mol N—H键、1 mol N≡N 键分别需要的能量是436 kJ、391 kJ、946 kJ。则图中的a=________ kJ;1 mol N2(g) 完全反应生成NH3(g)产生的能量变化为________ kJ。
(3)推测反应 2NH3(l)=== 2N2 (g)+3H2(g) 比反应2NH3(g)=== 2N2 (g)+3H2(g) ______(填“吸收”或“放出”)的热量________(填“多”或“少”)。
-
化学反应N2(g)+3H2(g)  2NH3(g)的能量变化如图所示(△E为能量变化值,a、b、c均为正值)。下列相关说法正确的是
2NH3(g)的能量变化如图所示(△E为能量变化值,a、b、c均为正值)。下列相关说法正确的是
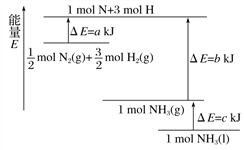
A.此反应为吸热反应
B.1mol N+3mol H中的总能量等于1mol NH3中的能量
C.1mol NH3(l)转变为1mol NH3(g)需要吸收c kJ能量
D.反应N2(g)+3H2(g)  2NH3(g)的能量变化值为a+b
2NH3(g)的能量变化值为a+b
2NH3(g) ΔH= Q kJ·mol-1,能量变化如图所示,回答
下列问题:

,H2为0.30
mol,NH3为0.10 mol。计算该条件下达到平衡时H2的转化率________。


