-
下列所加物质的作用与其还原性有关的是
A
B
C
D




腌咸菜加氯化钠
食用盐中加碘酸钾
红酒中添加SO2
泡打粉加碳酸氢钠
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列属于吸热反应的是
A. 氧化钙与水反应 B. 铁丝在氧气中燃烧
C. NaOH溶液与盐酸反应 D. Ba(OH)2·8H2O晶体与NH4Cl晶体反应
难度: 简单查看答案及解析
-
乙酸是一种常见的有机物。下列有关乙酸的化学用语中,不正确的是
A. 实验式:CH2O B. 比例模型:

C. 甲基的电子式:
D. 电离方程式:CH3COOH
CH3COO-+ H+
难度: 简单查看答案及解析
-
下列事实不能用元素周期律解释的是
A. 酸性:HClO4 > H2SO3 B. 碱性:NaOH > Mg(OH)2
C. 气态氢化物的稳定性:H2O > H2S D. Cl2从NaBr溶液中置换出Br2
难度: 中等查看答案及解析
-
下列关于自然界中氮循环(如右图)的说法不正确的是
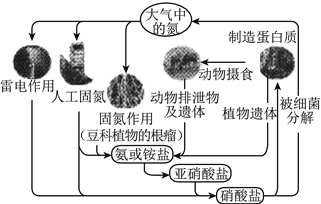
A. 人工固氮可以得到硝酸盐
B. 细菌对氮元素的循环有重要作用
C. 雷电作用可以将氮气直接转化为铵盐
D. 亚硝酸盐转化为硝酸盐的过程中,氮元素被氧化
难度: 中等查看答案及解析
-
下列说法正确的是
A. 1 mol NH3中含有的质子数约为6.02×1023
B. 0.5 mol·L− 1 NaCl溶液中含Cl-的物质的量为0.5 mol
C. 8 g S在足量O2中完全燃烧转移的电子数约为9.03×1023
D. 标准状况下,22.4 L SO2和CO2的混合气体所含原子数约为1.806×1024
难度: 中等查看答案及解析
-
咖啡酸具有较广泛的抑菌作用,其结构简式如下。下列关于咖啡酸的说法不正确的是
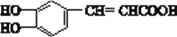
A. 能发生加聚反应
B. 能与溴水发生反应
C. 能与H2发生加成反应
D. 1 mol咖啡酸最多消耗1 mol NaOH
难度: 简单查看答案及解析
-
一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中●和○代表不同元素的原子。

关于此反应的说法不正确的是
A. 反应物总能量一定低于生成物总能量 B. 一定属于可逆反应
C. 一定有非极性共价键断裂 D. 一定属于氧化还原反应
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A. 金属Na加入水中:Na + 2H2O == Na+ + 2OH-+ H2↑
B. NaOH溶液吸收Cl2:Cl2 + 2OH-== Cl-+ ClO-+ H2O
C. Al2(SO4)3溶液和过量的NaOH溶液反应:Al3++3OH-== Al(OH)3↓
D. 过量的Fe和稀硝酸反应:Fe + 4H+ + NO3—== Fe3+ + NO↑+ 2H2O
难度: 困难查看答案及解析
-
常温下,下列各组离子能大量共存的是
A. pH=1的溶液中:Ba2+、NH4+、NO3−、Fe2+
B. 无色溶液中:H+、K+、I−、MnO4−
C. 在c(H+)∶c(OH−)=1∶1012的溶液中:Na+、CO32−、NO3−、SO42−
D. 由水电离出的c(OH−)=1.0×10− 13 mol·L− 1的溶液中:Na+、NH4+、SO42−、HCO3−
难度: 困难查看答案及解析
-
下列叙述正确的是
A. 向混有苯酚的苯中加入浓溴水,过滤,可除去其中的苯酚
B. 向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液褪色,说明维生素C有还原性
C. 向淀粉溶液中加稀硫酸,加热,加新制Cu(OH)2浊液,加热未见红色沉淀,说明淀粉未水解
D. 向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷水解
难度: 困难查看答案及解析
-
下列反应的发生与“难溶电解质的溶解平衡”或“盐类水解平衡”无关的是
A. 镁条与NH4Cl溶液反应生成H2 B. NaHSO4溶液与NaOH溶液反应生成Na2SO4
C. 盐酸与CaCO3反应生成CO2 D. Al2(SO4)3溶液和NaHCO3溶液反应生成CO2
难度: 困难查看答案及解析
-
下列方法中,可以使0.10 mol·L− 1 氨水中NH3·H2O的电离程度减小的是
A. 加入少量0.10 mol·L− 1盐酸 B. 加水稀释
C. 加入少量0.10 mol·L− 1NaOH溶液 D. 加入少量NaCl固体
难度: 中等查看答案及解析
-
猜想与假设是基于部分证据得出的不确定结论。下列猜想与假设不合理的是
A. Ca与H2O反应可能生成H2
B. SO2和H2O2反应可能生成H2SO4
C. 浓硫酸与乙醇在一定条件下反应产生的黑色物质可能是碳单质
D. H2C2O4溶液与H2SO4酸化的KMnO4溶液反应,先慢后快,催化剂可能是K+
难度: 困难查看答案及解析
-
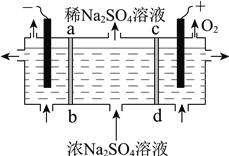
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。
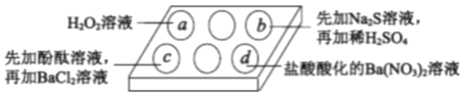
下列关于实验现象的解释或结论正确的是
选项
实验现象
解释或结论
A
a中无明显现象
Na2SO3和H2O2一定不发生反应
B
b中加稀H2SO4后才产生淡黄色沉淀
SO32−和S2−两种离子一定不能大量共存
C
c中加BaCl2溶液后产生白色沉淀且红色褪去
Ba2++ SO32− == BaSO3↓,使SO32−水解平衡逆向移动,红色褪去
D
d中产生白色沉淀
原Na2SO3溶液中含有SO42−
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
在10 L密闭容器中充入气体X和Y,发生反应X(g) + Y(g)
M(g) + N(g) ΔH,所得实验数据如下表:
实验
编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.40
0.10
0.080
③
800
0.20
0.05
a
下列说法正确的是
A. ①中,若5 min末测得n (M)=0.050 mol,则0至5 min内,用N表示的平均反应速率υ (N)=1.0×10− 2 mol/(L·min)
B. 800 ℃,该反应的平衡常数K=2.0
C. ③中,达到平衡时,Y的转化率为80%
D. ΔH>0
难度: 困难查看答案及解析