-
氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH) 、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
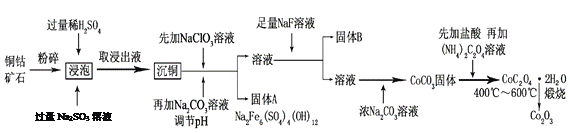
Ⅰ.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡。
Ⅱ.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a [主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b。
Ⅳ.Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在400 ℃~600 ℃煅烧,即得到Co2O3。
请回答:
(1)Ⅰ中,稀硫酸溶解CoCO3的化学方程式是________,加入Na2SO3溶液的主要作用是________。
(2)根据图1、图2分析:
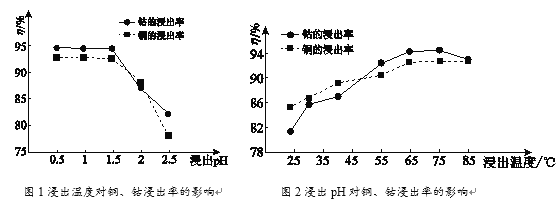
①矿石粉末浸泡的适宜条件应是________。
②图2中铜、钴浸出率下降的可能原因是________。
(3)Ⅱ中,浸出液中的金属离子与NaClO3反应的离子方程式:ClO3− + + == Cl− + + __________ ,________________
(4)Ⅱ中,检验铁元素完全除去的试剂是________,实验现象是________。
(5)Ⅱ、Ⅳ中,加入Na2CO3 的作用分别是________、________。
(6)Ⅲ中,沉淀b的成分是MgF2 、________(填化学式)。
(7)Ⅴ中,分离出纯净的CoC2O4·2H2O的操作是________。
-
氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺流程如下:
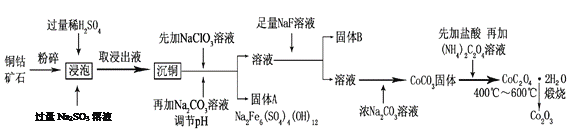
请回答下列问题:
(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,请将该反应的化学方程式补充完整:
2CoO(OH)+2H2SO4+□_______=□CoSO4+□_______+□_______,_____________
(2)固体B的成分是______________________(填化学式)。
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是___________________;若上述流程中固、液分离均采用过滤操作,则共有________________处使用该操作。
(4)根据图1、图2分析:
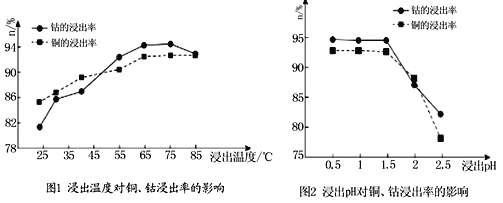
①矿石粉末浸泡的适宜条件应是________________________________。
②图2中铜、钴浸出率下降的可能原因是___________________________________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是_____________。
(6)LiCoO2可用于电动汽车的电池,其工作原理如右图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为:LixC6+Li1-xCoO2  C6 +LiCoO2
C6 +LiCoO2
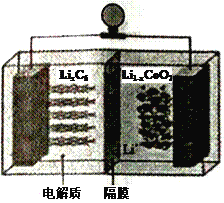
①放电时,Li+移动的方向为_________→___________。(填“ 左”或“ 右”)
②放电时正极的电极反应式为______________________________________。
-
氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺流程如下:
请回答下列问题:
(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,请将该反应的化学方程式补充完整:
2CoO(OH)+2H2SO4+□_______=□CoSO4+□_______+□_______,_____________
(2)固体B的成分是______________________(填化学式)。
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是___________________;若上述流程中固、液分离均采用过滤操作,则共有________________处使用该操作。
(4)根据图1、图2分析:
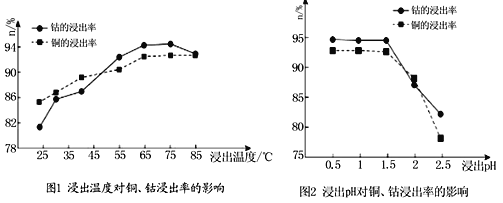
①矿石粉末浸泡的适宜条件应是________________________________。
②图2中铜、钴浸出率下降的可能原因是___________________________________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是_____________。
(6)LiCoO2可用于电动汽车的电池,其工作原理如右图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为:LixC6+Li1-xCoO2  C6 +LiCoO2
C6 +LiCoO2
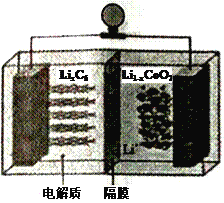
①放电时,Li+移动的方向为_________→___________。(填“ 左”或“ 右”)
②放电时正极的电极反应式为______________________________________。
-
三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钴矿石制备Co2O3的工艺流程如图所示。
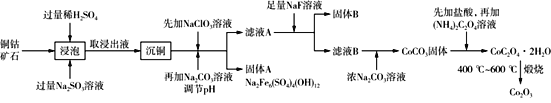
已知:铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。请回答下列问题:
(1)“浸泡”过程中可以加快反应速率和提高原料利用率的方法是_______(写出2种即可)。
(2)“浸泡”过程中,加入Na2SO3溶液的主要作用是____________。
(3)向“沉铜”后的滤液中加入NaClO3溶液,写出滤液中的金属离子与NaClO3反应的离子方程式________________。
(4)温度、pH对铜、钴浸出率的影响如图1、图2所示:
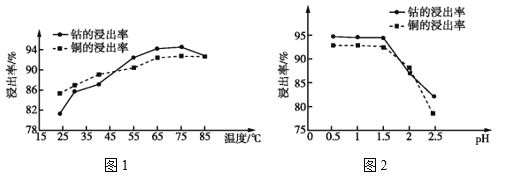
①“浸泡”铜钴矿石的适宜条件为__________________。
②图2中pH增大时铜、钴浸出率下降的原因可能是___________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是________。
(6)一定温度下,向滤液A中加入足量的NaF溶液可将Ca2+、Mg2+沉淀而除去,若所得滤液B中c(Mg2+)=1.0×10-5 mol/L,则滤液B中c(Ca2+)为______。[已知该温度下Ksp(CaF2)=3.4×10-11,Ksp(MgF2)=7.1×10-11]
-
某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如下:
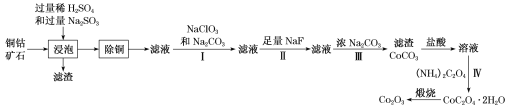
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的化学方程式:________。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=________。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3反应的离子方程式为_______。
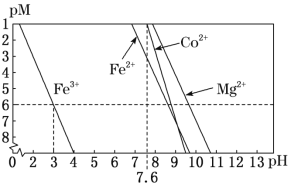
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(CO2+)为0.1mol•L–1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为_____。[当c(Mn+)≤10–6 mol•L–1,即认为该金属离子沉淀完全]
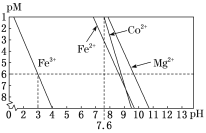
(4)步骤II中加入足量NaF的目的是________。
(5)过滤出的CoC2O4•2H2O固体经洗涤后,证明固体已洗净的操作为________。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为________。
-
某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如图:
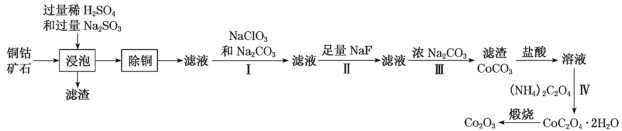
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的相关化学方程式:__。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=__。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3与Fe2+反应的离子方程式为__。
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(Co2+)为0.1mol•L-1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为__。[当c(Mn+)≤10–6mol•L–1,即认为该金属离子沉淀完全]
(4)步骤II中加入足量NaF的目的是__。
(5)过滤出的CoC2O4•2H2O固体经洗涤后,证明固体已洗净的操作为__。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为__。
-
CoCO3主要用作选矿剂、伪装涂料的颜料等。用钴矿石(含Co2O3·CoO及少量Fe2O3、Al2O3、MnO2等)生产CoCO3的流程如下:
下表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1)
| Al3+ | Fe3+ | Fe2+ | Mn2+ | Co2+ |
| 开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.7 | 7.6 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.6 | 9.8 | 9.2 |
(1)写出“浸取”步骤Co2O3·CoO发生反应的离子方程式 ______________________ 。
(2)“浸取”步骤除Co2O3·CoO外,钴矿石中还能被Na2SO3还原的物质有______ (填化学式)。
(3)加NaClO3的目的是氧化Fe2+,NaClO3的用量过多会造成的不良后果是 _________ 。
(4)“沉钴”步骤向CoCl2溶液加入NH4HCO3溶液需要55~57 ℃条件下进行,温度控制在
55~57 ℃的原因为 ________________________________________________________ 。

(5)已知金属萃取剂对金属离子的萃取率与pH的关系如图所示。请补充完整由“氧化”后的溶液制备CoCO3的实验方案:向“氧化”后的溶液中加入_______________________,得较纯CoCl2溶液,加入NH4HCO3溶液沉钴得CoCO3。(实验中须使用试剂:Na2CO3溶液、金属萃取剂、盐酸)。
-
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中制取高纯碳酸钴(CoCO3)的工艺流程如下:
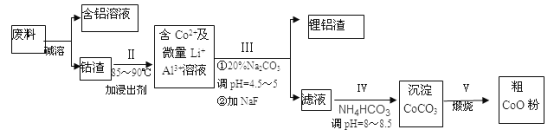
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为_________________________。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的离子反应方程
式为_____________________(产物中只有一种酸根)。也可用H2SO4和H2O2代替H2SO4、Na2S2O3,那么该反应的化学方程式为______________;但若用HC1代替H2SO4会造成的后果是______________。
(3)过程Ⅲ中碳酸钠溶液的作用是沉淀Al3+和Li+,写出沉淀Al3+的离子方程式___________________。
(4)过程Ⅳ沉钴的离子方程式是______________________。
(5)CoCO3可用于制备锂离子电池的正极材料LiCoO2,其生产工艺是将n(Li):n(Co)=l:l的LiCO3和CoCO3的固体混合物在空气中加热至700℃~900℃。试写出该反应的化学方程式________。
-
光催化技术是一种在能源和环境领域有着重要应用前景的绿色技术。Ti的某种晶型的氧化物M可用作光催化材料。
(1)基态Ti原子的价层电子排布图为________。
(2)在第四周期d区元素中,与Ti 原子未成对电子数相同的元素名称是________。
(3)金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为_____。

(4)生活环境中的臭气源有氨气、甲硫醇(CH3-SH) 等,M 可以作为高效除臭剂。与氨气互为等电子体的阳离子为_____,甲硫醇中硫原子采取的杂化方式为_____,与S位于同一周期,且第一电离能小于S 的非金属元素符号为______,已知甲硫醇熔沸点小于甲醇(CH3OH),试解释此差异的主要原因___________。
(5)M 的晶胞结构如图2,M 化学式为______。
(6)石墨烯是单个原子厚度的二维碳纳米材料( 如图3),其比表面积大( 比表面积指单位质量物料所具有的总面积)。石墨烯与M 的结合使用,极大地提高了M 的光催化效果。在石墨烯晶体中,每个最小的六元环占有____个C 原子。已知石墨烯中C-C 键长为a pm,则单层石墨烯的比表面积为_____m2/g(NA表示阿伏伽德罗常数的数值,忽略碳原子的厚度)。
-
纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到.[已知:硫酸铝铵晶体的倾学式为(NH4)A1(SO4)n•12H2O].制备硫酸铝铵晶体的实验流程如图(1):
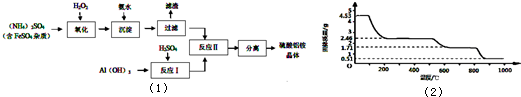
(1)检验上述流程中“过滤”后杂质是否除尽的实验方法是________.
(2)上述流程中,“分离”所包含的操作依次为:________、________、过滤、洗涤、干燥.
(3)硫酸铝铵水溶液呈酸性的原因是________(用离子方程式表示).
(4)写出上述“反应Ⅱ”中获得硫酸铝铵晶体的化学方程式________.
(5)向硫酸铝铵溶液中加入氢氧化钡溶液至A13+刚好沉淀完全,写出反应的离子方程式________.
(6)取4.53g硫酸铝铵晶体加热分解,加热过程中,固体质量随时间的变化如图(2)所示:写出400℃时剩余固体成分的化学式________.

















