-
甲醇是重要的化工原料,发展前景广阔。
(1)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如右图所示:A极是________极(填“正”或“负”),其电极反应式是________。

(2)研究表明CO2加氢可以合成甲醇。CO2和H2可发生如下两个反应:
I.CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1
CH3OH(g) + H2O(g) ΔH1
II.CO2(g) + H2(g) CO(g) + H2O(g) ΔH2
CO(g) + H2O(g) ΔH2
①反应I的化学平衡常数表达式K=________。
②有利于提高反应I中 CO2的平衡转化率的措施有________(填序号)。
a.使用催化剂 b.加压 c.增大CO2和H2的初始投料比
③研究温度对于甲醇产率的影响。在210 ℃~290 ℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂甲,主要发生反应I,得到甲醇的实际产率、平衡产率与温度的关系如右图所示。

ΔH1________0(填“>”、“=”或“<”),其依据是________。
④某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态):
| T(K) | CO2实际转化率(%) | 甲醇选择性(%)【注】 |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
【注】甲醇选择性:转化的CO2中生成甲醇的百分比
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是________。
-
微生物燃料电池(Microbial Fuel Cell,MFC)是一种利用微生物将有机物中的化学能直接转化成电能的装置。最早用于有机废水处理,下图是利用微生物燃料电池处理含甲醛废水的装置,其中3是质子交换膜,下列有关说法不正确的是

A.负极发生的反应为:HCHO-4e-+H2O=CO2+4H+
B.负极所在的左室中需保持厌氧环境
C.O2参与正极反应,发生还原反应
D.NH4+通过循环操作最终被转化成N2
-
微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。如图是一种微生物燃料电池的工作原理示意图,下列有关说法不正确的是
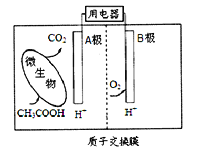
A. B电极是正极
B. 电池内H+从左侧向右侧迁移
C. A电极的电极反应式: CH3COOH + 8e-+ 2H2O=2CO2 +8H+
D. 该电池可利用有机废水等有机废弃物作为燃料
-
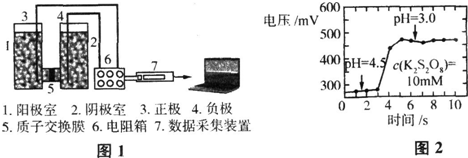
微生物燃料电池简称MFC,是一种新型的燃料电池,它是以微生物作催化剂,以有机废水为燃料,将有机废水中的化学能直接转化为电能的一种装置.重庆大学工程热物理研究所在实验室中构建了一种“H”型微生物燃料电池,实验装置图如图1所示,总反应为2CH3COOK+4H2O+8K2S2O8═4CO2↑+7H2SO4+9K2SO4.研究表明,电池电压的高低受到多样因素的影响,并且实验中发现,在其他条件不变的情况下降低K2S2O8溶液的pH,电池所提供的电压会上升,如图2所示.下列推断肯定错误的是( )

A.正极反应:S2O82-+2e-═2SO42-
B.负极附近电解质溶液pH会降低
C.增大CH3COOK的浓度一定不会有利于提高电池的电压
D.降低K2S2O8溶液中pH,电压会上升的原因可能是c(H+)增大使得S2O82-的氧化性增强,从而提高了电池的整体性能
-
微生物燃料电池简称MFC,是一种新型的燃料电池,它是以微生物作催化剂,以有机废水为燃料,将有机废水中的化学能直接转化为电能的一种装置.重庆大学工程热物理研究所在实验室中构建了一种“H”型微生物燃料电池,实验装置图如图1所示,总反应为2CH3COOK+4H2O+8K2S2O8═4CO2↑+7H2SO4+9K2SO4.研究表明,电池电压的高低受到多样因素的影响,并且实验中发现,在其他条件不变的情况下降低K2S2O8溶液的pH,电池所提供的电压会上升,如图2所示.下列推断肯定错误的是( )
A.正极反应:S2O82-+2e-═2SO42-
B.负极附近电解质溶液pH会降低
C.增大CH3COOK的浓度一定不会有利于提高电池的电压
D.降低K2S2O8溶液中pH,电压会上升的原因可能是c(H+)增大使得S2O82-的氧化性增强,从而提高了电池的整体性能
-
(14分)燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池,除氢气外,烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料。请回答下列问题:
(1)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池.写出其正极反应式
________。
(2)以上述电池为电源,通过导线与图14电解池相连。
(Ⅰ)X、Y为石墨,a为1L0.1mol/L的氯化钾溶液,写出电解总反应的离子方程式
________。
(II)X、Y分别为铁、铜,a为1L0.1mol/L硫酸铜溶液,写出X电极反应式
________。

(3)室温时,按(I)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到图15(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
①结合图15计算消耗标准状况下甲烷________mL。
②若图15的B点pH=7,则酸碱恰好完全反应的点是________区间(填“AB”、“BC”或“CD”)。
③AB区间溶液中各离子浓度大小关系是________。

-
利用微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。电池工作时,下列说法正确的是
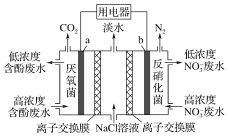
A. a极为正极,发生氧化反应
B. b极的电极反应式为:2NO3-+12H++10e-===N2↑+6H2O
C. 中间室的Cl-向右室移动
D. 左室消耗苯酚 (C6H5OH) 9.4 g时,用电器流过2.4 mol电子
-
利用一种微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。电池工作时,下列说法正确的是
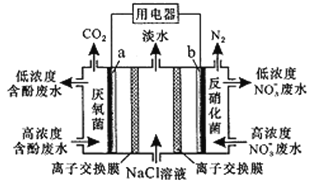
A. a 为正极,发生氧化反应
B. b极上的电极反应为:2NO3-+12H+-10e-=N2↑+6H2O
C. 中间室的Cl-向左室移动
D. 左室消耗苯酚(C6H5OH) 9.4g时,用电器流过2.4mol电子
-
一种新型污水处理装置如图所示。该装置可利用一种微生物将有机废水的化学能直接转化为电能。下列说法中不正确的是
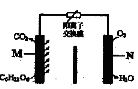
A.电池工作时H+从M极区移向N极区
B.N极为正极,发生还原反应
C.M极的电极反应式为 C6H12 O6 +6H2O-24e-=6CO2↑+24 H+
D.当N极消耗5.6 L(标况下)气体时,则有2 NA个H+通过离子交换膜
-
下列有关化学与生活、工业的叙述中,正确的是( )
A.工业上生产水泥、玻璃、陶瓷,均需要用石灰石为原料
B.石英是良好的半导体材料,可以制成光电池,将光能直接转化成电能
C.面粉中禁止添加CaO2 、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物
D.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油的成分与从石油中提取的柴油成分不同

CH3OH(g) + H2O(g) ΔH1
CO(g) + H2O(g) ΔH2









