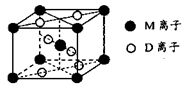
-
近年来,食品安全事故频繁发生,人们对食品添加剂的认识逐渐加深。下列关于食品添加 剂的认识正确的是
A.食品添加剂必须用纯天然物质才对人体无害
B.SO2漂白生成的无色物质不稳定,可广泛用于食品漂白
C.我们每一个人都要多食用加碘食盐和加铁酱油
D.食醋中含少量乙酸,可同时用作防腐剂和调味剂
难度: 中等查看答案及解析
-
实现下列实验目的的装置或操作正确的是
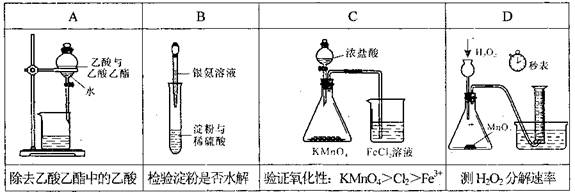
难度: 中等查看答案及解析
-
下列离子或分子在溶液中能大量共存,加入足量Na2O2后仍能大量共存的是
A.K+、Cl-、Na+、SO32- B.Ba2+、NO3-、Al3+、Br-
C.K+、NH4+、I-、CO32- D.Na+、Cu2+、NH3·H2O、SO42-
难度: 中等查看答案及解析
-
已知X、Y、Z、W为短周期元素,原子序数依次增大。X、Z同族且均为金属元素,Y、W同族,W的最高价氧化物对应的水化物是强酸。下列说法错误的是
A.原子半径:Z>W>Y B. X的最高价氧化物的水化物一定是强碱
C.氢化物的沸点:W—定小于Y D.Y与Z形成的化合物一定是离子晶体
难度: 中等查看答案及解析
-
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+
O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于
A.-417.91kJ·mol-1 B.-319.68 kJ·mol-1
C.+546.69 kJ·mol-1 D.-448.46 kJ·mol-1
难度: 中等查看答案及解析
-
25°C时,c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、 c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是
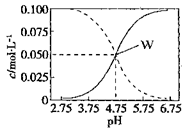
A.pH=4的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+ c(H+)= c(CH3COOH)+c(OH-)
C.将W点所表示的1.0L溶液稀释到10L,用pH计测量,溶液的pH应为5.75
D.pH=5.5的溶液中:c(Na+)+ c(H+)- c(OH-)+c(CH3COOH)=0.1mol/L
难度: 困难查看答案及解析
-
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)
CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是

A.曲线II对应的条件改变是增大压强
B.T2°C时,上述反应平衡常数为0.42,则T2> T1
C.在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆)
D.在T10C,若起始时向容器由通入4,5 molCO2、6mol H2 ,平衡时容器内压强
难度: 困难查看答案及解析