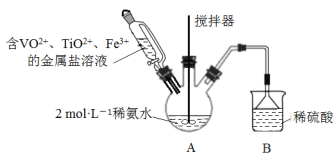
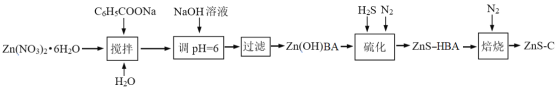
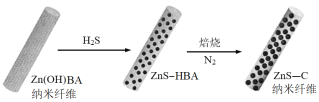
-
化学与生产生活息息相关,下列说法错误的是
A. 秸秆大量焚烧将产生雾霾
B. 由地沟油炼制的生物柴油属于烃类物质
C. “山东疫苗案”涉及的疫苗,因未冷藏储运而失效,这与蛋白质变性有关
D. 建设港珠澳大桥时采用超高分子量聚乙烯(UHMWPE)纤维吊绳,UHMWPE属于有机高分子化合物
难度: 简单查看答案及解析
-
香菇是含烟酸较高的食物,烟酸分子中六元环的结构与苯环相似。下列有关烟酸的说法错误的是
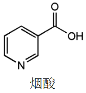
A. 所有的碳原子均处同一平面
B. 与硝基苯互为同分异构体
C. 六元环上的一氯代物有5种
D. 1mol烟酸能和3mol氢气发生加成反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关说法正确的是
A. 3.4gH2S分子中含H+离子数为0.2 NA
B. 1 L 0.5mol·L-1乙酸溶液中O-H键数目为0.5 NA
C. 1.0 mol O22-核外电子数为16 NA
D. 标况下2.24LSO2通入足量氯水中完全反应,转移电子数为0.2NA
难度: 中等查看答案及解析
-
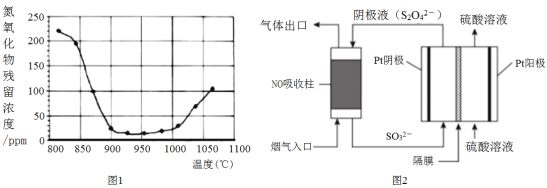
科学家开发出Na-CO2电池如下图所示。下列说法错误的是
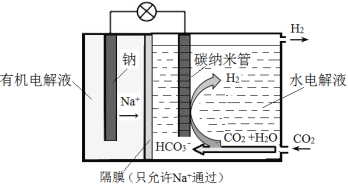
A. 电池放电时,钠发生氧化反应
B. 正极的电极反应式:2CO2 + 2H2O + 2e- = 2HCO3- + H2↑
C. 理论上消耗23g钠,同时产生22.4L氢气(标准状况)
D. 该装置既可以吸收二氧化碳,又能产生电能、氢燃料
难度: 中等查看答案及解析
-
根据下列实验操作与现象得出的结论正确的是
选项
实验操作与现象
结 论
A
向滴有酚酞的碳酸钠溶液中加入少量氯化钡固体, 红色变浅
碳酸钠溶液中存在水解平衡
B
向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解
该溶液中一定含有[Al(OH)4]-
C
将润湿的淀粉碘化钾试纸置于集满某气体的集气瓶口,试纸变蓝
该气体为氯气
D
向10mL 0.5mol·L-1的氯化镁溶液中滴加5mL 2.4mol·L-1氢氧化钠溶液,产生白色沉淀再滴加氯化铜溶液,沉淀变蓝
Ksp[Cu(OH)2 ]<Ksp[Mg(OH)2 ]
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X是短周期元素中原子半径最小的,Y、W同主族,且Y、W的原子序数之差与Z的原子序数相同,X、Y、Z、W的最外层电子数之和为15。下列说法错误的是
A. 原子半径:W>Y>Z
B. WY可用于制造高温结构陶瓷
C. Y2X4能使酸性高锰酸钾溶液褪色
D. Y单质与WZ2在高温条件下反应生成W单质,说明非金属性:Y>W
难度: 中等查看答案及解析
-
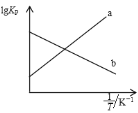
25℃时,用NaOH调节0.10 mol/L H2C2O4溶液的pH,假设不同pH下均有c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol/L。使用数字传感器测得溶液中各含碳微粒的物质的量浓度随pH的变化曲线如下图。下列有关分析正确的是
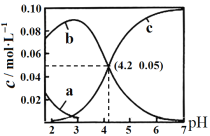
A. 曲线b代表H2C2O4浓度随pH的变化
B. HC2O4-
H+ + C2O42- K=1×10-4.2
C. pH从4到6时主要发生反应的离子方程式为2OH-+H2C2O4 =2H2O+C2O42-
D. 当溶液pH=7时:c(Na+)>c(C2O42-)> c(H2C2O4)>c (HC2O4-)
难度: 中等查看答案及解析