-
化学与生产生活密切相关,下列说法不正确的是
A. “卤水点豆腐”运用了胶体电泳的性质
B.
有漂白性,可漂白草帽和纸浆
C. NaCl既可以做调味品,也可以做食品防腐剂
D. 清乾隆“瓷母”是指各种釉彩大瓶,它们的主要成分是硅酸盐
难度: 简单查看答案及解析
-
下列说法正确的是
A. 0.1molFe溶于硝酸,电子转移数目一定为0.3
B. 标准状况下,14.4g正戊烷(
)中含C-C键数目为0.8N
C. 18g重水(
)中含中子数目为10
D. 12g熔融
中含离子总数目为0.3
难度: 中等查看答案及解析
-
根据下图(其他产物未写出)分析,下列说法正确的是

A. A和B生成C的反应为加成反应
B. C中所有原子可能在同一平面
C. B的分子式为
D. C苯环上的二氯代物只有两种
难度: 中等查看答案及解析
-
短周期元素T、X、Y、Z、W在元素周期表中的相对位置如下表所示,其中T的单质在一定条件下能与W的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,则下列相关说法正确的是

A. 离子半径:X<Y<W
B. 最简单气态氢化物的热稳定性:W<Z
C.
分子中每个原子均满足8电子稳定结构
D. 最高价氧化物对应水化物的碱性:X<Y
难度: 中等查看答案及解析
-
下列实验能达到预期目的的
A.
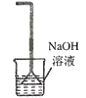 吸收HCl尾气
吸收HCl尾气B.
 进行喷泉实验
进行喷泉实验C.
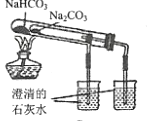 比较
比较和
的热稳定性
D.
 制少量NaClO为主要成分的消毒液
制少量NaClO为主要成分的消毒液难度: 简单查看答案及解析
-
锂锰电池结构如图所示,其中电解质
溶于混合有机溶剂中,
通过电解质迁移入
晶格中生成
。下列有关说法正确的是

A. 外电路电流方向:a→b
B. 电池正极反应式为:
C. 可以用水代替电池中的混合有机溶剂
D. 用该电池给铅蓄电池充电,a极与Pb电极相连
难度: 中等查看答案及解析
-
常温下,将
mL 1mo/L
和
mL 1mo/L
两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
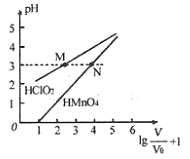
A.
和
均为一元弱酸
B. 在0≤pH≤5时,
溶液满足
C. 分别往M、N两点对应溶液中滴加1 mo/L NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等
D. 常温下,浓度均为0.1 mo/L的
和
溶液,溶液pH:
>
难度: 中等查看答案及解析
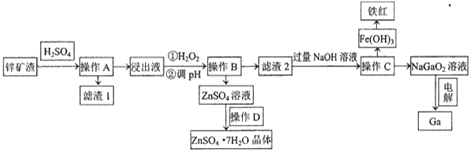
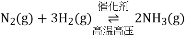 △H=a kJ/mol
△H=a kJ/mol
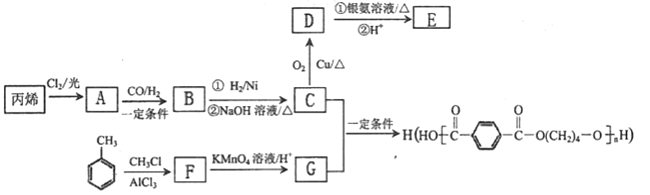
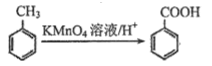
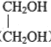 )为某原料制备聚酯纤维
)为某原料制备聚酯纤维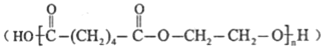 的合成路线________________(无机试剂任选)。
的合成路线________________(无机试剂任选)。