-
下列分散系中,分散质粒子大小在1~100nm之间的是( )
A. 泥水 B. 油水 C. Fe(OH)3胶体 D. CuSO4溶液
难度: 简单查看答案及解析
-
刚刚过去的春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质(结构简式如下图)在化学人的朋友圈中火了起来。该物质属于
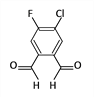
A. 单质 B. 无机物
C. 有机物 D. 氧化物
难度: 简单查看答案及解析
-
下列说法错误的是
A. CO燃烧是放热反应 B. H2SO4与NaOH反应是放热反应
C. CaCO3受热分解是吸热反应 D. CaO与H2O反应是吸热反应
难度: 简单查看答案及解析
-
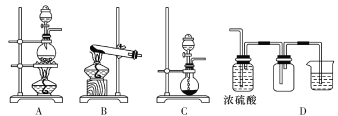
下列仪器的名称为“蒸馏烧瓶”的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列物质中,属于弱电解质的是
A. 铜 B. 硝酸钾 C. 纯醋酸 D. 氢氧化钠
难度: 简单查看答案及解析
-
近期,我国科学家在利用镓(6831Ga)进行肿瘤的早期精准诊断方面取得了重大突破。下列关于6831Ga的说法正确的是
A. 质子数为31 B. 中子数为68
C. 质量数为99 D. 核外电子数为37
难度: 简单查看答案及解析
-
同分异构现象是有机物种类繁多的原因之一。下列与CH3CH2CH2CH2OH互为同分异构体的是
A. CH3CH2CH2CHO B. (CH3)3COH
C. (CH3)2CHCH2COOH D. CH3CH2CH2CH2CH2OH
难度: 简单查看答案及解析
-
下列元素中,属于第ⅠA族的是
A. 氟 B. 钾 C. 磷 D. 铁
难度: 简单查看答案及解析
-
下列过程需用到萃取操作的是
A. 用CCl4提取水中溶解的I2 B. 油和水的分离
C. 压榨花生获取花生油 D. 除去粗盐中的杂质
难度: 简单查看答案及解析
-
下列离子可以在溶液中大量共存的是
A. Na+、Ba2+、Cl-、SO42- B. H+、K+、NO3-、CO32-
C. Cu2+、H+、NO3-、SO42- D. K+ 、OH-、Cl-、H+
难度: 中等查看答案及解析
-
在汽车尾气的处理装置中的发生反应:4CO+2NO2
4CO2+N2。下列有关该反应的说法正确的是
A. CO是氧化剂 B. CO2是氧化产物
C. NO2发生氧化反应 D. NO2失去电子
难度: 简单查看答案及解析
-
用5 mol/L 的HNO3溶液配制500 mL 1 mol/L的HNO3溶液时,不需用到的仪器是
A. 分液漏斗 B. 胶头滴管 C. 烧杯 D. 500 mL容量瓶
难度: 简单查看答案及解析
-
下列物质属于烷烃的是
A. CH3COOH B. CH2=CH2
C. CH3CH2OH D. CH3CH3
难度: 简单查看答案及解析
-
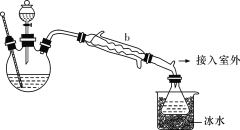
探究Cu和浓硫酸的反应,下列装置或操作正确的是
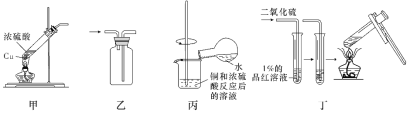
A. 用装置甲、乙制备SO2和收集SO2
B. 用装置甲、丙制备SO2和稀释CuSO4溶液
C. 用装置乙、丁收集SO2和检验SO2的漂白性
D. 用装置甲、丁制备SO2和探究SO2的漂白性
难度: 中等查看答案及解析
-
反应3H2+N2
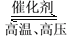 2NH3在容积固定的密闭容器中进行。下列做法无法加快反应速率的是
2NH3在容积固定的密闭容器中进行。下列做法无法加快反应速率的是A. 升高温度
B. 使用高效的催化剂
C. 增大N2的浓度
D. 充入稀有气体增大装置内的压强
难度: 简单查看答案及解析
-
下列化学用语表达正确的是
A. 氯原子的结构示意图:
B. 乙酸的结构式:C2H4O2
C. 氯化氢分子的电子式:
D. 硫酸钠的电离方程式:Na2SO4===2Na++SO42-
难度: 简单查看答案及解析
-
坩埚是实验室用于灼烧或熔融固体物质的常用仪器,材质很多,实验时应根据物质的性质加以选择。下列坩埚能用于熔融烧碱的是
A. 普通玻璃坩埚 B. 石英坩埚
C. 陶瓷坩埚 D. 铁坩埚
难度: 简单查看答案及解析
-
下列关于常见物质的应用中,正确的是
A. 二氧化硅可做电脑芯片
B. 漂白粉可用作食品的漂白剂
C. 烧碱可用于治疗胃酸过多
D. 小苏打可作发酵粉
难度: 简单查看答案及解析
-
对下列有机反应类型的认识中,不正确的是
A.
取代反应
B. CH4+Cl2
CH3Cl+HCl 置换反应
C. CH2===CH2+H2O
CH3CH2OH 加成反应
D. 2CH3CH2OH+O2
2CH3CHO+2H2O 氧化反应
难度: 简单查看答案及解析
-
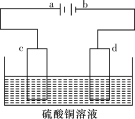
某原电池装置示意图如图所示。下列有关该原电池的说法正确的是
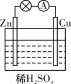
A. 锌片是正极
B. 溶液中H+由铜电极移向锌电极
C. 铜片上有气泡产生
D. 电子由铜电极经导线流向锌电极
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A. Cu与浓硝酸的反应:Cu+2H+=Cu2++H2↑
B. FeCl2溶液与Cl2的反应:Fe2++Cl2=Fe3++2Cl-
C. H2SO4溶液与KOH溶液的反应:H++OH-=H2O
D. 钠与水的反应:Na+H2O=Na++OH-+H2↑
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,22.4 L水中所含原子数为3NA
B. 1 L 1 mol/L CuCl2溶液中含有的氯离子数为2NA
C. 常温常压下,11.2 L氯化氢气体中含有的分子数为0.5NA
D. NaCl的摩尔质量是58.5 g
难度: 中等查看答案及解析
-
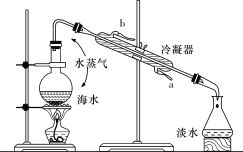
运用下列实验装置和操作能达到实验目的和要求的是
A.
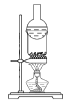 分离氯化铵和单质碘
分离氯化铵和单质碘B.
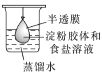 除去淀粉胶体中混有的氯化钠
除去淀粉胶体中混有的氯化钠C.
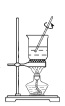 加热胆矾(CuSO4·5H2O)制取无水硫酸铜
加热胆矾(CuSO4·5H2O)制取无水硫酸铜D.
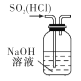 除去SO2中的HCl
除去SO2中的HCl难度: 简单查看答案及解析
-
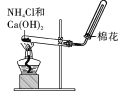
下列实验操作与安全事故处理的描述错误的有______句。
①将甲烷和乙烯的混合气体通过盛有酸性高锰酸钾溶液的洗气瓶,即可提纯甲烷
②配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉
③活泼金属着火,不可用泡沫灭火器灭火
④把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水润湿的玻璃管插入端,缓慢旋进塞孔中
⑤做完银镜反应后,试管上的附着物可用浓氨水洗涤
⑥盛装液溴的细口瓶要加水液封
⑦用湿润的pH试纸测定氯水的pH
A. 三 B. 四 C. 五 D. 六
难度: 简单查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是
选项
操作和现象
结论
A
向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体
HNO3分解生成了NO2
B
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成
淀粉没有水解成葡萄糖
C
向无水乙醇中加入浓H2SO4,加热至170 ℃,产生的气体通入酸性KMnO4溶液,溶液褪色
使溶液褪色的气体是乙烯
D
向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊
析出了NaHCO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某碳酸钾样品中含有碳酸钠、硝酸钾和硝酸钡三种杂质中的一种或两种,现将13.8 g样品加入足量水中,样品全部溶解,再加入过量的氯化钙溶液,得到9 g沉淀,下列对样品所含杂质的判断正确的是
A. 肯定没有硝酸钾
B. 肯定有硝酸钾,可能还有碳酸钠
C. 肯定没有硝酸钡,可能有硝酸钾
D. 肯定没有碳酸钠和硝酸钡
难度: 中等查看答案及解析
-
同学们在做铜与浓硝酸反应的实验时,发现反应后溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确,这些方案中不可行的是
A. 加水稀释该绿色溶液,观察溶液颜色变化
B. 加热该绿色溶液,观察溶液颜色变化
C. 向该绿色溶液中通入氮气,观察溶液颜色变化
D. 向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察溶液颜色变化
难度: 中等查看答案及解析
-
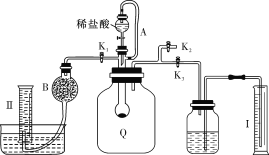
实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
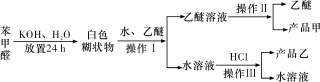
根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
难度: 中等查看答案及解析