-
在容积固定的密闭容器中,发生反应CO2(g) + H2(g)  CO(g) + H2O(g),化学平衡常数K和温度t的关系如下表:
CO(g) + H2O(g),化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K = ______________________;
(2)该反应为_________反应(填“吸热”或“放热”。)
(3)能判断该反应达到化学平衡状态的是________(填字母)。
a.容器中总压强不变
b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等
d.c(CO2)= c(CO)
-
(1)在一固定容积的密闭容器中发生反应CO2(g)+H2(g) CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为__________;
②该反应的正反应为__________反应(填“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是______(填字母代号)。
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa
⑥NH4Cl,其水溶液呈碱性的有________(填序号);常温下,0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是__________(填离子符号);
②判断Ksp[Fe(OH)2]________Ksp[Mg(OH)2](填“>”“=”或“<”)。
(4)某电解装置如图所示。
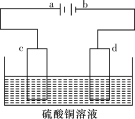
①当用惰性电极电解时,d电极的反应式为________________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量,发现两极质量差为16 g,则电路中转移的电子的物质的量为________mol。
-
(16分)在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g)  CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)该反应的逆反应为 反应(“吸热”或“放热”);
(2)不能判断该反应是否已经达到化学平衡状态的是:________
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(3) 在850℃时,可逆反应:CO2(g) + H2(g)  CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2 O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
计算:3min—4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。
-
(22分)在一固定容积的密闭容器中进行着如下反应:CO2(g) + H2(g)  CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1) K的表达式为:________________________;
(2) 该反应的正反应为 _______反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是:________
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g)  CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2 O (mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
①前2min,用CO2表示该化学反应的速率是________________________________;
②在3-4min之间,反应处于_____________状态(填“平衡”或“非平衡”)。
③计算:3min—4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出计算过程(850℃时,K值从上表可查出;c3精确到小数点后面三位数)。
-
在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g)  CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1) K的表达式为: ;
(2) 该反应的正反应为 反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:________
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2) =" c(CO)=" c(H2) = c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
 此时上述的反应中正、逆反应速率的关系式是________(填代号)。
此时上述的反应中正、逆反应速率的关系式是________(填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
-
在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g)  CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:____;
(2)该反应的正反应为___反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:_________
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2) = c(CO)= c(H2) = c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时上述的反应中正、逆反应速率的关系式是___________(填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
(5)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率___(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其原因________。
-
在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其平衡常数K和温度t的关系如下:
| T/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为: .
(2)该反应的正反应为 反应(“吸热”或“放热”).
(3)能判断该反应是否已经达到化学平衡状态的是 .
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=C(CO)
-
在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:______;
(2)该反应的正反应为______反应(“吸热”或“放热”)
(3)能判断该反应是否已经达到化学平衡状态的是:______
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
E.容器中气体密度不变 F.1mol H-H键断裂的同时断裂2mol H-O键
(4)在850℃时,可逆反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O(mol/L) |
| 0.200 | 0.300 | | |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
计算:CO的平衡浓度c3,要求写出简单的计算过程.
-
在一个固定容积的密闭容器中,有如下反应:
CO(g)+H2O(g) CO2(g)+H2(g);△H=QkJ·mol-1,其化学平衡常数K和温度t的关系如下
CO2(g)+H2(g);△H=QkJ·mol-1,其化学平衡常数K和温度t的关系如下
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.25 |
(1) 上述反应中Q 0(选填“>”或“<”)
(2) 下列各项能判断该反应已达到化学平衡状态的是
a. 容器中压强不变 b. △H不变
c. v正(H2)=v逆(CO) d. CO的质量分数不变
(3) 温度为850℃时,可逆反应:CO(g)+H2O(g) CO2(g)+H2(g) 在固定容积的密闭容器中进行,容器 内各物质的浓度变化如下表:850℃时各物质的浓度(mol·L-1) 变化
CO2(g)+H2(g) 在固定容积的密闭容器中进行,容器 内各物质的浓度变化如下表:850℃时各物质的浓度(mol·L-1) 变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
① 计算:0~4min时, H2O(g)的转化率= 。
② 表中5min~6min之间数值发生变化,可能的原因是________。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
-
本题为《化学反应原理(选修4)》选做题。
(1)在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g) CO(g)+H2O(g),其平衡常数K和温度T的关系如下:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为____________________;
②该反应的正反应为__________反应(“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是____________(填字母代号)。
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl,溶液呈碱性的有__________(填序号);常温下0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是 ____________(填离子符号);
②判断Ksp[Fe(OH)2] ____________Ksp[Mg(OH)2](填“>”、“=”或“<”)。
(4)电解装置如图所示:

①当用惰性电极电解时,d电极的反应式为____________________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量发现两极质量差为16 g,则电路中转移的电子为____________mol。
CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:

