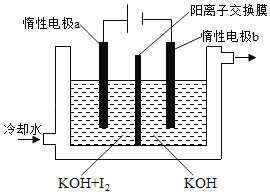
-
根据下列实验操作和现象所得的结论正确的是( )
选项
实验操作和现象
结论
A
相同条件下,分别测量0.1mol•L-1和0.01mol•L-1的醋酸溶液的导电性,前者的导电性强
醋酸浓度越大,电离程度越大
B
将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液,溶液变成红色
原Fe(NO3)2中一定含有Fe3+
C
向AgCl悬浊液中滴入KI溶液,悬浊液变为黄色
Ksp(AgCl)>Ksp(AgI)
D
常温下,分别测量浓度均为0.1mol•L-1的Na2S溶液和NaClO溶液的pH,前者的pH大
酸性:HClO>H2S
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A.向0.1mol•L-1CH3COOH溶液中加入少量水,溶液中
减小
B.向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中
增大
C.向一定浓度的醋酸溶液中加水稀释,则溶液中
增大
D.40℃时,在氨水体系中不断通入CO2,随着CO2的通入,
不断增大
难度: 中等查看答案及解析
-
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾
B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
C.弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3‾
D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾
难度: 中等查看答案及解析
-
已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO42-。某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述不正确的是
A. 该温度高于25℃
B. 由水电离出来的H+的浓度为1×10-10 mol·L-1
C. 加入NaHSO4晶体抑制了水的电离
D. 取该溶液加水稀释100倍,溶液中的c(OH-)减小
难度: 中等查看答案及解析
-
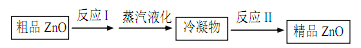
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
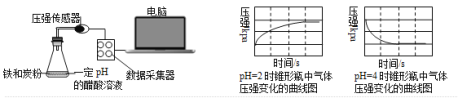
分析图像,以下结论错误的是( )
A.析氢腐蚀和吸氧腐蚀的速率一样快
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.溶液pH≤2时,生铁发生析氢腐蚀
D.两溶液中负极反应均为Fe – 2e- = Fe2+
难度: 中等查看答案及解析
-
对可逆反应2A(s)+3B(g)
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
难度: 中等查看答案及解析
-
有4种混合溶液,分别由等体积0.1 mol/L的两种溶液混合而成:
①NH4Cl与CH3COONa ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合液呈碱性)
下列各项排序正确的是( )
A.pH:②<①<③<④ B.溶液中c(H+):①<③<②<④
C.c(NH):①<③<②<④ D.c(NH3·H2O):①<③<④<②
难度: 中等查看答案及解析
-
下列结论中正确的是( )
A.稀释醋酸钠溶液,CH3COO-的水解程度变大,故溶液的pH变大
B.常温下Ka=1×10-5的浓度为0.1mol·L-1的HA溶液,其pH≈3
C.c(SO32-)相等的Na2SO3溶液、NaHSO3溶液、H2SO3溶液的浓度:c(NaHSO3)>c(H2SO3)>c(Na2SO3)
D.25℃时,向10mL0.01mol·L-1KOH溶液中滴加10mL0.01mol·L-1醋酸所得混合溶液中:c(K+)=c(CH3COO-)>c(OH-)=c(H+)
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
C.用饱和氯化铵溶液可以清洗金属表面的锈迹
D.在NaHS溶液中,滴入少量CuCl2溶液,产生黑色沉淀,HS-水解程度增大,pH增大
难度: 中等查看答案及解析
-
一种钌(Ru)配合物光敏太阳能电池工作原理及电池中发生的反应如下所示。下列说法正确的是( )
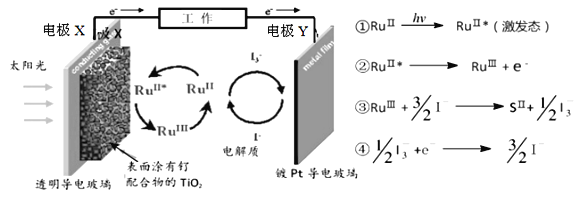
A.电极X为电池的正极
B.电池工作时,光能→化学能→电能
C.电池工作时,I-在电极Y上得电子
D.电池电解质溶液中I-和I3-的浓度不断减少
难度: 困难查看答案及解析
-
某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则
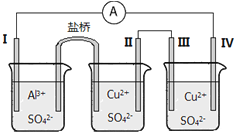
A.电流方向:电极IV→
→电极I
B.电极I发生还原反应
C.电极II逐渐溶解
D.电极III的电极反应:Cu2++2e-==Cu
难度: 中等查看答案及解析
-
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O
HClO+H++Cl- K2=10-3.4
HClO
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )
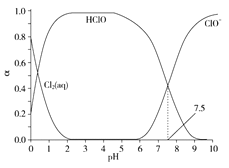
A.Cl2(g)+H2O
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
难度: 中等查看答案及解析