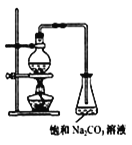
-
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N
N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是 ( )
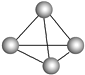
A. N4属于一种新型的化合物 B. N4分子中存在极性键
C. N4分子中N—N键角为109°28′ D. 1 mol N4转变成N2将放出882 kJ热量
难度: 中等查看答案及解析
-
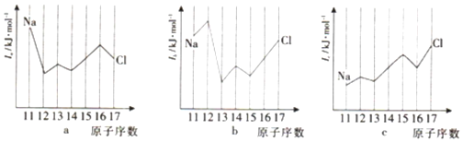
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,下列说法错误的是( )
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A. 元素X的常见化合价是+1价
B. 元素Y是第ⅢA族元素
C. 元素X与氯形成化合物时,化学式可能是XCl
D. 若元素Y处于第三周期,则它可与冷水剧烈反应
难度: 中等查看答案及解析
-
下列对电子排布式或电子排布图书写的评价正确的是( )
选项
电子排布式或电子排布图
评价
A.
O原子的电子排布图:
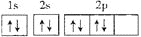
错误;违反泡利不相容原理
B.
N原子的电子排布图:
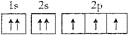
错误;违反洪特规则
C.
Ca原子的电子排布式:1s22s22p63s23p63d2
错误;违反能量最低原理
D.
Br-的电子排布式:[Ar]3d104s24p6
错误;违反能量最低原理
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
氰气的分子式为(CN)2,结构式为N
C-C
N,其性质与卤素单质相似,下列叙述不正确的是( )
A.N
C键的键能大于C
C键的键能 B.(CN)2分子中含有3个σ键和2个π键
C.N
C键的键长小于C
C键的键长 D.(CN)2能与NaOH溶液反应
难度: 简单查看答案及解析
-
在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的( )
A.2Na2O2+2H2O=4NaOH+O2↑
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.Cl2+H2O=HClO+HCl
D.NH4Cl+NaOH
NaCl+NH3↑+H2O
难度: 简单查看答案及解析
-
下列四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3③1s22s22p3 ④1s22s22p5,则下列有关的比较中正确的是
A. 第一电离能:④>③>②>①
B. 原子半径:④>③>②>①
C. 电负性:④>②>①>③
D. 最高正化合价:④>③=②>①
难度: 困难查看答案及解析
-
下列有关多电子原子的叙述中正确的是( )
A.在一个多电子原子中,不可能有两个运动状态完全相同的电子
B.在一个多电子原子中,不可能有两个能量相同的电子
C.在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高
D.某个多电子原子的3p能级上仅有两个电子,它们的自旋状态必然相反
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.17g NH3中含有的电子数为8NA
B.1mol H2O2中含有极性键的数目为3NA
C.标准状况下,22.4L四氯化碳所含分子数为NA
D.28 g C2H4和C3H6的混合物中含有的碳原子数为2NA
难度: 中等查看答案及解析
-
甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:
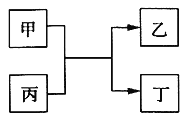
下列说法正确的是( )
A. 若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
B. 若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
C. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
D. 若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
难度: 困难查看答案及解析
-
已知X、Y、Z、W原子序数都不超过18,它们的离子aX(n+1)+、bYn+、cZ(n+1)﹣、dWn﹣具有相同的电子层结构,则下列说法正确的是( )
A. 原子序数:a>b>c>d
B. 离子半径:X(n+1)+>Yn+>Z(n+1)﹣>Wn﹣
C. 离子氧化性:X(n+1)+>Yn+
D. 单质氧化性:Z>W
难度: 困难查看答案及解析
-
2019年是联合国确立的“国际化学元素周期表年”。X、Y、Z、M、R是核电荷数依次增加的五种短周期主族元素,其中M最外层电子数为3。M单质可与化合物ZYX水溶液反应,也可与化合物XR水溶液反应,且均产生X单质。下列说法不正确的是
A.五种元素中有两种元素处于相同的主族
B.Y与X、Y与Z可形成两种化合物
C.M与Y、M与R形成的化合物中化学键类型相同
D.M与Y形成的化合物既可用来冶炼M,也可用作耐火材料
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A.麦芽糖及其水解产物均能发生银镜反应
B.塑料、合成纤维和合成橡胶被称为“三大合成材料”
C.用甘氨酸(H2N-CH2-COOH)和苯丙氨酸(
 )缩合最多可形成4种二肽
)缩合最多可形成4种二肽D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
难度: 简单查看答案及解析
-
下列关系正确的是( )
A.熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷
B.密度:CHCl3>H2O>己烷
C.氢元素的质量分数:甲烷>乙烷>乙烯>乙炔>苯
D.等质量物质完全燃烧耗O2量:苯>环已烷>已烷
难度: 简单查看答案及解析
-
下列有机物实际存在且命名正确的是( )
A.2-甲基-5-乙基己烷 B.3,3-二甲基-2-戊烯
C.3-甲基-2-丁烯 D.2,2-二甲基丙烷
难度: 简单查看答案及解析
-
用下图所示装置检验乙烯时不需要除杂的是( )
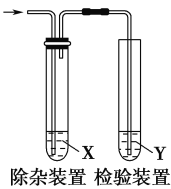
选项
乙烯的制备
试剂X
试剂Y
A
CH3CH2Br与NaOH乙醇溶液共热
H2O
KMnO4酸性溶液
B
CH3CH2Br与NaOH乙醇溶液共热
H2O
Br2的CCl4溶液
C
C2H5OH与浓H2SO4加热至170 ℃
NaOH溶液
KMnO4酸性溶液
D
C2H5OH与浓H2SO4加热至170 ℃
NaOH溶液
Br2的CCl4溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某有机物A是农药生产中的一种中间体,其结构简式如下。下列叙述中正确的是
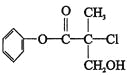
A.有机物A 属于芳香烃
B.有机物A 可以与Br2的CCl4溶液发生加成反应
C.有机物A 与浓硫酸混合加热,可以发生消去反应
D.1 mo1A 与足量的NaOH 溶液反应,最多可以消耗3mol NaOH
难度: 中等查看答案及解析
-
将有机物完全燃烧,生成CO2和H2O。将12 g该有机物的完全燃烧产物通过浓硫酸,浓硫酸增重14.4g,再通过碱石灰,碱石灰增重26.4g。则该有机物的分子式为( )
A. C4H10 B. C2H6O C. C3H8O D. C2H4O2
难度: 中等查看答案及解析
-
某羧酸酯的分子式为C18H26O5,1mol该酯完全水解得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
A.C14H18O5 B.C16H25O4 C.C14H22O5 D.C14H10O4
难度: 中等查看答案及解析
-
下列三种有机物是某些药物中的有效成分:
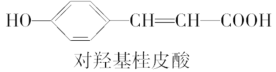
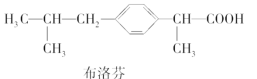

以下说法正确的是( )
A.三种有机物都能与浓溴水发生反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多
D.使用FeCl3溶液和稀硫酸不能鉴别出这三种有机物
难度: 简单查看答案及解析
-
某烃的相对分子质量为86,如果分子中含有3个
、2个
和1个
,则该结构的烃的一氯取代物最多可能有
不考虑立体异构
A.9种 B.6种 C.5种 D.4种
难度: 中等查看答案及解析
-
已知某有机物结构如图,下列说法中正确的是
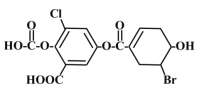
A. 该物质的化学式为C15H8O8BrCl
B. 该物质能与
溶液发生显色反应
C. 1mol该物质最多能与3mol溴水发生加成反应
D. 一定条件下,1mol该物质最多能与8molNaOH反应
难度: 困难查看答案及解析
-
某高分子材料的结构如图所示:已知该高分子材料是由三种单体聚合而成的,以下与此高分子材料相关的说法正确的是( )

A.三种单体中有两种有机物互为同系物
B.三种单体都可以使溴水褪色,但只有两种能使酸性高锰酸钾溶液褪色
C.形成该高分子材料的单体
中,所有原子一定处于同一平面
D.该高分子材料是体型高分子,合成它的反应是加聚反应
难度: 中等查看答案及解析
-
已知某有机物X的结构简式如图所示,下列有关叙述不正确的是
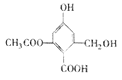
A.X能使KMnO4溶液褪色
B.X在一定条件下能与FeCl3溶液发生显色反应
C.X在一定条件下能发生消去反应和酯化反应
D.1molX分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3mol、4mol、1mol
难度: 中等查看答案及解析
-
在20℃时,某气态烃与氧气混合装入密闭容器中,点燃爆炸后,又恢复到20℃。此时容器内气体的压强为反应前的一半,经NaOH溶液吸收后,容器内几乎真空。此烃的化学式可能是
A.CH4 B.C3H4 C.C2H2 D.C3H8
难度: 简单查看答案及解析
-
某烃的结构简式为
,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是
A.4、3、5 B.2、5、4 C.4、3、6 D.4、6、4
难度: 简单查看答案及解析
-
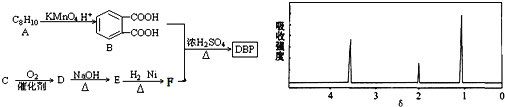
化合物A的相对分子质量为136,分子式为C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱和核磁共振氢谱如下图。下列关于A的说法中不正确的是
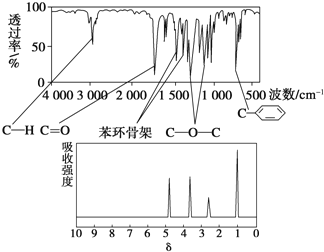
A.与A属于同类化合物的同分异构体只有4种
B.符合题中A分子结构特征的有机物只有1种
C.A在一定条件下可与3 molH2发生加成反应
D.A分子属于酯类化合物,在一定条件下能发生水解反应
难度: 中等查看答案及解析

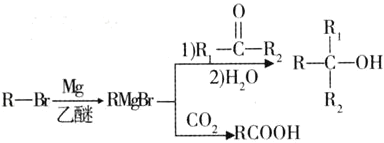
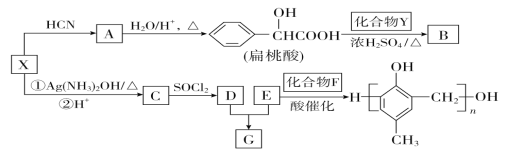
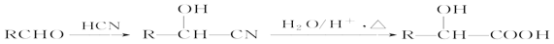
 (R、R’代表烃基)
(R、R’代表烃基)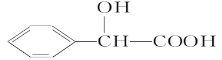 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。