-
雌黄(As2S3)在我国古代常用作书写涂改修正胶。浓硝酸氧化雌黄可制得硫黄,并生成砷酸和一种红棕色气体,利用此反应原理设计为某原电池。下列有关叙述正确的是
A. 砷酸的分子式为H2AsO4
B. 红棕色气体在该原电池的负极区生成并逸出
C. 该反应的氧化剂和还原剂物质的量之比为12:1
D. 该反应中每析出4.8g硫黄,则转移0.5mol电子
难度: 中等查看答案及解析
-
从古至今化学与生产、生活密切相关。下列说法正确的是
A.常温下,成语“金戈铁马”中的金属能溶于浓硝酸
B.用石灰水或MgSO4溶液喷涂在树干上均可消灭树皮上的过冬虫卵
C.汉代烧制出“明如镜、声如馨”的瓷器,其主要原料为石灰石
D.港珠澳大桥采用的聚乙烯纤维吊绳,其商品名为“力纶”,是有机高分子化合物
难度: 简单查看答案及解析
-
化学家创造的酸碱质子理论的要点是:凡能给出质子(H+)的分子或离子都是酸,凡能接受质子(H+)的分子或离子都是碱。按此观点,下列微粒既属于酸又属于碱的是
①H2O ②CO32- ③Al3+ ④CH3COOH ⑤NH4+⑥H2N-CH2COOH
A.②③ B.①⑥ C.④⑥ D.⑤⑥
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于冶金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C
Na2S+2CO2↑。下列有关说法正确的是
A.1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA
B.1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA
C.生成1mol还原产物时转移电子数为8NA
D.通常状况下,11.2L.CO2中含有的共价键数目为2NA
难度: 中等查看答案及解析
-
室温下,下列各组微粒在指定溶液中能大量共存的是
A.pH=1的溶液中:CH3CH2OH、Cr2O72-、K+、SO42-
B.c(Ca2+)=0.1mol·L-1的溶液中:NH4+、C2O42-、Cl-、Br-
C.含大量HCO3-的溶液中:C6H5O-、CO32-、Br-、K+
D.能使甲基橙变为橙色的溶液:Na+、NH4+、CO32-、Cl-
难度: 中等查看答案及解析
-
我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
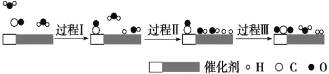
下列说法正确的是
A. 图示显示:起始时的2个H2O最终都参与了反应
B. 过程Ⅰ、过程Ⅱ均为放热过程
C. 过程Ⅲ只生成了极性共价键
D. 使用催化剂降低了水煤气变换反应的ΔH
难度: 中等查看答案及解析
-
被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,分别为X、Y、Z、W、R、T。其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相 等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与 R原子序数之和是W的2倍。下列说法错误的是
A.离子半径:R>T>Y>Z
B.XR2、WR2两种化合物中R的化合价相同
C.最高价氧化物对应的水化物的碱性:X>Z
D.气态氢化物的稳定性:W<R<T
难度: 简单查看答案及解析
-
一种新药物结构如图所示,下列有关该化合物说法正确的是
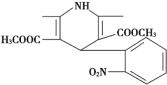
A.分子式为C17H17N2O6
B.能发生水解反应、聚合反应、取代反应、消去反应
C.分子中含有四种不同的官能团
D.能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应
难度: 简单查看答案及解析
-
工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯。提取柠檬烯的实验操作步骤如下:柠檬烯
①将1〜2个橙子皮剪成细碎的碎片,投人乙装置中,加入约30mL水,
②松开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧, 打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。下列说法不正确的是
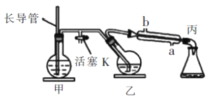
A.当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B.为达到实验目的,应将甲中的长导管换成温度计
C.蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热
D.要得到纯精油,还需要用到以下分离提纯方法:分馏、蒸馏
难度: 简单查看答案及解析
-
不同条件下,用O2氧化a mol/L FeCl2溶液过程中所 测的实验数据如图所示。下列分析或推测合理的是
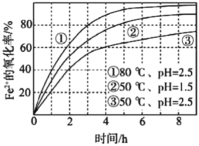
A.由①、②可知,pH越大,+2价铁越易被氧化
B.由②、③推测,若pH>7,+2价铁更难被还原
C.由①、③推测,FeCl2被O2氧化的反应为放热反应
D.60℃、pH=2.5时,4 h内Fe2+的平均消耗速率大于0.15a mol/(L·h)
难度: 中等查看答案及解析
-
海水淡化是解决沿海城市饮用水问题的关键技术。下图是电渗析法淡化海水装置的工作原理示意图(电解槽内部的“┆”和“│”表示不同类型的离子交换膜)。工作过程中b电极上持续产生Cl2。下列关于该装置的说法错误的是
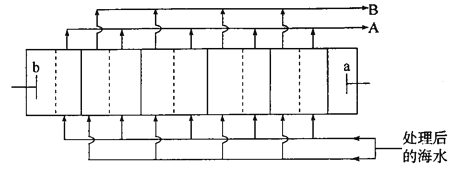
A. 工作过程中b极电势高于a极
B. “┆”表示阴离子交换膜,“│”表示阳离子交换膜
C. 海水预处理主要是除去Ca2+、Mg2+等
D. A口流出的是“浓水”,B口流出的是淡水
难度: 中等查看答案及解析
-
下列实验操作、现象和所得到的结论均正确的是
选项
实验内容
实验结论
A
取两只试管,分别加入4mL0.01mol·L-1KMnO4酸性溶液,然后向一只试管中加入0.01mol·L-1H2C2O4溶液2mL,向另一只试管中加入0.01mol·L-1H2C2O4溶液4mL,第一只试管中溶液褪色时间长
H2C2O4浓度越大,反应速率越快
B
室温下,用pH试纸分别测定浓度为0.1mol·L-1HClO溶液和0.1mol·L-1HF溶液的pH,前者pH大于后者
HclO的酸性小于pH
C
检验FeCl2溶液中是否含有Fe2+时,将溶液滴入酸性KMnO4溶液,溶液紫红色褪去
不能证明溶液中含有Fe2+
D
取两只试管,分别加入等体积等浓度的双氧水,然后试管①中加入0.01mol·L-1FeCl3溶液2mL,向试管②中加入0.01mol·L-1CuCl2溶液2mL,试管①中产生气泡快
加入FeCl3时,双氧水分解反应的活化能较大
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
某恒定温度下,在一个2L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A (g)+2B (g)⇌4C (?)+2D (?),“?”代表状态不确定。反应一段时间后达到平衡,测得生成 1.6 mol C,且反应前后压强之比为5:4,则下列说法正确的是
A.增加C,B的平衡转化率不变
B.此时B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.该反应的化学平衡常数表达式是K=
难度: 中等查看答案及解析
-
常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )
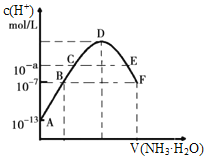
A.NaHB溶液可能为酸性,也可能为碱性
B.A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C.E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D.F点溶液c(NH4+)=2c(B2-)
难度: 困难查看答案及解析
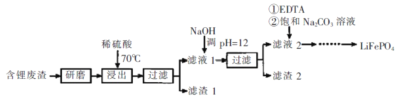
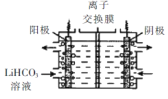
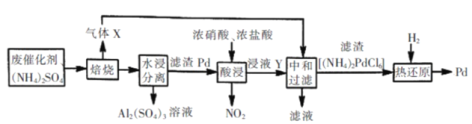
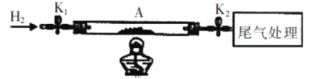
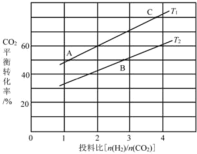
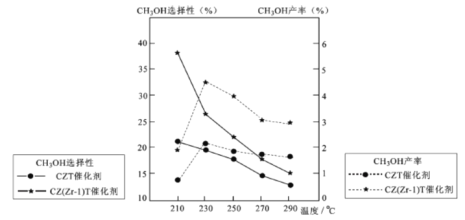
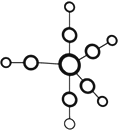
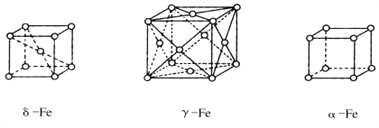
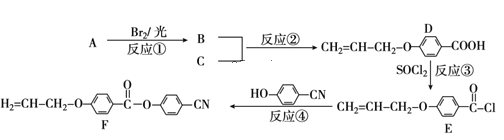
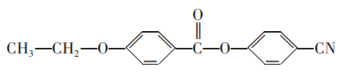 的合成路线流程图(无机试剂任用)___。
的合成路线流程图(无机试剂任用)___。