-
2018年6月5日是第47个世界环境日,主题为“塑战速决”,呼吁全世界齐心协力对抗一次性塑料污染问题。下列做法不应提倡的是
A. 大量生产超薄塑料袋
B. 将塑料垃圾回收再生
C. 生产可降解绿色替代品
D. 少用或不用一次性塑料制品
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 直径为2.5μm的颗粒在空气中形成气溶胶
B. 用可见光束照射可区别溶液和胶体
C. 氨水可以导电,说明NH3是电解质
D. 氧化还原反应都是放热反应
难度: 简单查看答案及解析
-
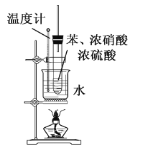
实验室制硝基苯的反应原理为
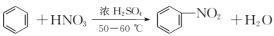 ,在制备和纯化硝基苯的实验中,下列操作未涉及的是
,在制备和纯化硝基苯的实验中,下列操作未涉及的是A.
 B.
B. 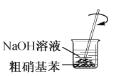
C.
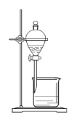 D.
D. 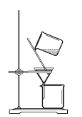
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 18g重水(D2O)所含的电子数目为10NA
B. Na2O2与足量的水反应生成1 molO2,转移电子数目为2NA
C. 100 mL1 mol•L-1 FeCl3溶液中含有 Fe3+数目为 0.1NA
D. 将2molSO2和1molO2充分反应,转移的电子数目为4NA
难度: 中等查看答案及解析
-
光化学烟雾的形成机理如图所示。下列叙述错误的是
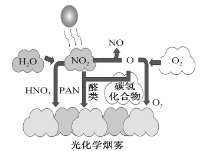
A. 光化学烟雾的分散剂是空气
B. 氧原子是产生光化学烟雾的催化剂
C. PAN(
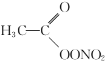 )属于有机物
)属于有机物D. 光化学烟雾与氮氧化物和碳氢化合物大量排放有关
难度: 中等查看答案及解析
-
甲烷与氧气反应过程中的能量变化如下图所示。下列有关说法中正确的是

A. 反应 CO2(g)+2H2O(l)==CH4(g)+2O2(g) △H<0
B. 若将1mol CO2(g)、2 molH2O(l)的能量标在图中,则其位置在①、②之间
C. 若C一H键的键能为415kJ• mol-1,则O= O的键能为493 kJ• mol-1
D. 若该反应过程中转化的化学能为200kJ,则有0.25 molC=O生成
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 硫酸铝溶液中加入过量的氨水:A13++4NH3•H2O=A1O2-+4NH4+
B. 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O
C. 浓盐酸与二氧化锰混合加热:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
D. 石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列关于有机物的说法不正确的是
A. 乙烯和乙醇能相互转化且反应属于可逆反应
B. 用小苏打溶液可以鉴别乙酸、苯、乙醇三种无色液体
C. 苯、氯乙烯、乙烯分子中所有原子均在同一平面内
D. 分子式为C4H8O2的酯共有4种(不考虑立体异构)
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 100℃时,Kw= 10-12,则该温度下,NaCl溶液呈酸性
B. 25℃时,pH=12的溶液一定是碱溶液,pH=2的溶液一定是酸溶液
C. 等温下,AgCl在浓度均为0.1 mol•L-1的NaCl溶液、MgCl2溶液中Ksp相等
D. 等温下,饱和溶液的导电能力,BaCO3强于BaSO4,则Ksp(BaCO3)<Ksp(BaSO4)
难度: 中等查看答案及解析
-
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,W、X、Y、Z原子最外层电子数之和为16;W与Y同族;W、X、Z三种元素形成的化合物水溶液中逐滴加入Y的最高价氧化物对应水化物的溶液,先有白色沉淀,然后沉淀又逐渐溶解。下列说法正确的是
A. 相同压强下,W的单质沸点比Y的高
B. W的氢化物常温常压下为液态
C. Y、Z形成的化合物水溶液呈中性
D. 化合物中不可能同时存在W、X、Y、Z
难度: 中等查看答案及解析
-
电化学在日常生活中用途广泛,图甲是原电池,电池总反应为Mg+ClO-+H2O=Cl-+ Mg(OH)2,图乙是电解池,用于含Cr2O72-的工业废水的处理。下列说法错误的是
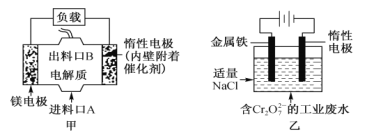
A. 图甲中发生的氧化反应是Mg—2e-=Mg2+
B. 图乙中惰性电极作电解池的阴极,电极棒上有H2放出
C. 图乙中Cr2O72-向惰性电极移动,该极附近有Cr(OH)3生成
D. 若图甲作为图乙的电源,当消耗3.6g镁时,理论上也消耗8.4g铁
难度: 中等查看答案及解析
-
下列实验过程可以达到实验目的的是
选项
实验目的
实验过程
A
移取15.00 mLKI溶液
向20 mL量筒加入KI溶液至刻度线15处,然后倒出
B
制取并纯化SO2
将浓硫酸滴入Na2SO3中,生成的气体依次通过饱和NaHCO3溶液、浓硫酸
C
比较BaSO4和BaSO3的Ksp
向盛有BaCl2溶液的试管中先加入Na2SO3溶液,然后加入Na2SO4,观察现象
D
探究H2O2的还原性
向盛有2mL酸性KMnO4溶液的试管中滴加浓的H2O2溶液,观察现象
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某溶液含有K+、Fe3+、SO42-、CO32-、I-中的几种。取样,滴加KSCN溶液后显血红色。下列判断错误的是
A. 一定存在的离子为Fe3+、SO42-
B. 一定不存在的离子为CO32-、I-
C. 不能确定的离子为K+、SO42-
D. 需要通过焰色反应来确定是否含有K+
难度: 中等查看答案及解析
-
常温下,用 0. 100 mol• L-1 的盐酸滴定 0.1 00 mol•L-1 的氨水,其滴定曲线如图所示:

下列说法正确的是
A. 该滴定操作可用甲基橙作指示剂
B. a 点溶液中:c(NH4+)>c(NH3 • H2O)>c(Cl- )
C. c 点溶液中:c(Cl-)>c(NH4+)>c(H+)
D. a→c过程中锥形瓶内水的电离度不断增大
难度: 中等查看答案及解析
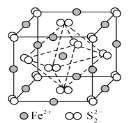


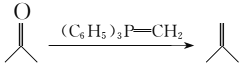 ;
;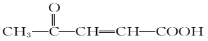 为原料制备
为原料制备 的合成路线:___________(其他无机试剂任选)。
的合成路线:___________(其他无机试剂任选)。