-
化学与生活联系密切,下列说法错误的是( )
A. 煤、石油、天然气是不可再生能源,风能、生物质能、沼气是可再生能源
B. 纽扣银锌电池体型小,含有害物质少,用后不用分类回收,可以随意处理
C. 草木灰中提取的K2CO3可以去除餐具上的油污
D. 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 根据能量守恒定律,反应物的总能量等于生成物的总能量
B. 断裂化学键会释放能量
C. 放热的化学反应不需要加热就能发生
D. 同温同压下,H2(g)+Cl2(g)=2 HCl(g)在光照和点燃条件下所放出的热量相同
难度: 简单查看答案及解析
-
常温下,测得柠檬水溶液的pH是3,其中的c(OH-)是( )mol/L:
A. 1×10-3 B. 0.1 C. 1×10-7 D. 1×10-11
难度: 简单查看答案及解析
-
表示下列变化的化学用语正确的是( )
A. NaHCO3溶液显碱性:HCO3-+H2O
CO32-+OH-
B. 醋酸溶液显酸性:CH3COOH=CH3COO-+H+
C. 氨水显碱性:NH3·H2O
NH4++OH-
D. 铁在潮湿空气中被腐蚀的负极反应:Fe-3e- =Fe3+
难度: 中等查看答案及解析
-
25℃时,下列事实中能说明HA为弱电解质的是( )
① NaA溶液的pH>7 ②用HA溶液做导电实验时灯泡很暗
③ pH=2的HA溶液稀释至100倍,pH 约为3.1 ④HA的溶解度比HCl的小
⑤ 用HA溶液浸泡水壶中的水垢,可将其清除
A. ①②③ B. ①②⑤ C. ①③④ D. ①③
难度: 中等查看答案及解析
-
下列关于中和滴定的操作错误的是( )
A. 滴定前需要检查滴定管是否漏水
B. 用待装溶液润洗的仪器有:酸式滴定管、锥形瓶
C. 用标准盐酸测定氨水的浓度,最适宜使用的指示剂是甲基橙
D. 已知浓度滴定未知溶液,终点读数时俯视滴定管的刻度,会造成计算值偏低
难度: 中等查看答案及解析
-
常温下将pH=8的NaOH溶液稀释1000倍,稀释后溶液中c(Na+)与c(OH-)之比接近( )
A. 1:1 B. 1:102 C. 102:1 D. 1:103
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A. pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B. 由水电离的c(H+)=1×10-14 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C. c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D. c(Fe3+)=0.1 mol•L-1的溶液中:K+、CO32-、NO3-、SCN-
难度: 中等查看答案及解析
-
下列有关化学符号表征正确的是( )
A. 电解法精炼铜,阴极电极反应:Cu2++2e-=Cu
B. H2S在水溶液中的电离:H2S
2H++S2-
C. 甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) ==CO2 (g)+2H2O (g) ΔH=-890.3kJ·mol-1
D. 碳酸钠水解的离子方程式:CO32-+2H2O
2OH-+H2CO3
难度: 简单查看答案及解析
-
下列实验误差分析不正确的是( )
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度差值△t偏小
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A. 向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 用惰性电极电解MgCl2溶液,电解的离子方程式为: 2Cl-+2H2O
H2↑+Cl2↑+2OH-
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3溶液,生成的沉淀AgCl多
难度: 中等查看答案及解析
-
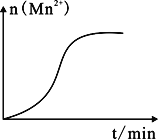
298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是

A. 溶液的pH不再变化
B. 2v正(I-)=v逆(AsO33-)
C. c(AsO43-)/c(AsO33-)不再变化
D. c(I-)=2ymol·L-1
难度: 中等查看答案及解析
-
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是
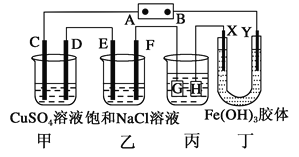
A. 电源B极是正极
B. (甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:1
C. 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D. 装置(丁)中Y极附近红褐色变深, 说明Fe(OH)3胶粒带正电荷
难度: 困难查看答案及解析
-
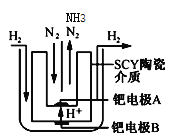
中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如下图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法正确的是
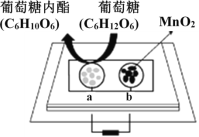
A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. 消耗0.01mol葡萄糖,电路中转移0.02mol电子
D. b极的电极反应式为:MnO2+2H2O+2e-=Mn2++4OH-
难度: 中等查看答案及解析
-
常温下,现有0.1mol•L-1 NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示:
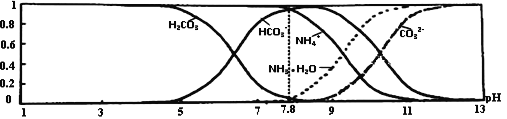
下列说法不正确的是( )
A. 分析可知,常温下Kb(NH3•H2O)>Ka1(H2CO3)
B. 0.1 mol•L-1 NH4HCO3溶液中存在:c(NH3•H2O)=c(H2CO3)+c(CO32-)
C. 当溶液的pH=9时,溶液中存在:c(HCO3-)>c(NH4+)>c(NH3•H2O)>c(CO32-)
D. 向pH=7.8的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3﹣浓度逐渐减小
难度: 中等查看答案及解析
-
下列是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式
AgCl
Ag2CrO4
CH3COOH
HClO
H2CO3
Ksp或Ka
Ksp=1.8×10-10
Ksp=9.0×10-12
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.1×10-7
Ka2=5.6×10-11
A. H2CO3、HCO3-、CH3COO-、ClO-在溶液中可以大量共存
B. 等体积等浓度的CH3COONa和NaClO中离子总数:CH3COONa<NaClO
C. 向浓度均为1.0×10-3 mol·L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol·L-1的AgNO3溶液,CrO42-先形成沉淀
D. 向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液的pH=5
难度: 困难查看答案及解析
-
已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1 mol/LNaOH 溶液滴定20mL 0.1 mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是( )
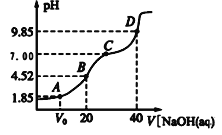
A. A点所得溶液中:V0<10mL
B. B点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C. C点所得溶液中:c(A2-)=c(Na+)-c(HA-)-c(H2A)
D. D点所得溶液中A2-水解平衡常数 Kh1=10-7.19
难度: 困难查看答案及解析
-
下列各组物质中,前者是强电解质,后者是弱电解质的是( )
A. NaCl、BaSO4 B. HCl、NaHSO4
C. KNO3、CH3COOH D. NH3·H2O、H2SO4
难度: 简单查看答案及解析
-
某化学反应其△H = + 122 kJ/mol,∆S= - 231 J/(mol·K),下列说法正确的是( )
A. 在任何温度下都不能自发进行 B. 在任何温度下都能自发进行
C. 仅在高温下自发进行 D. 仅在低温下自发进行
难度: 中等查看答案及解析
-
如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
难度: 中等查看答案及解析