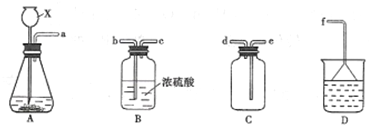
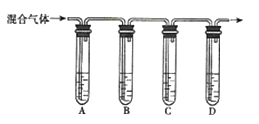
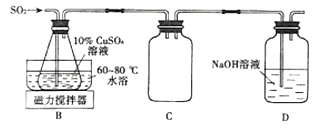
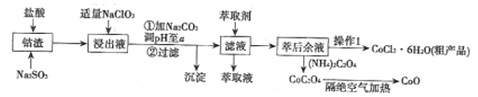
-
化学与人类生产、生活、科研密切相关,下列有关说法不正确的是
A. 维生素C常用作抗氧化剂,说明它具有还原性
B. 大力实施矿物燃料的脱硫脱硝技术,可以减少SO2、NO2的排放
C. 工业生产玻璃、水泥.均需用石灰石作原料
D. 糖类、蛋白质和油脂都属于营养物质,都能发生水解反应
难度: 困难查看答案及解析
-
下列关于有机化合物的说法正确的是
A. C3H6和C4H8化学性质一定相似
B. 甲烷的二氯代物(CH2Cl2)有2种同分异构体
C. 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体
D. 苯乙烯分子中的所有原子不可能处于同一平面
难度: 困难查看答案及解析
-
下列实验操作能达到预期实验目的的是
选项
实验目的
实验操作
A
比较H2SO4和H2CO3酸性强弱
分别测定饱和H2SO4和H2CO3溶液的pH
B
实验室制取CO2
将稀硫酸滴入CaCO3固体中
C
制备Fe(OH)3胶体
将饱和FeCl3溶液滴入NaOH溶液中
D
除去乙酸乙酯中的CH3COOH
加入饱和Na2CO3溶液,振荡后静置,分液
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
NA为阿伏加德罗常教的值,下列列说法正确的是
A. 标准状况下,22.4LNO与11.2LO2充分反应,产物的分子数为1.5NA
B. 14g乙烯和丙烯混合气体中含有C-H共价键的数目为2NA
C. 标准状况下,22.4L氯气与足量铁粉充分反应,转移的电子教为3NA
D. 100mL1mol/LKClO溶液中,阴离子的教目小于0.1NA
难度: 中等查看答案及解析
-
结合图判断,下列叙述正确的是
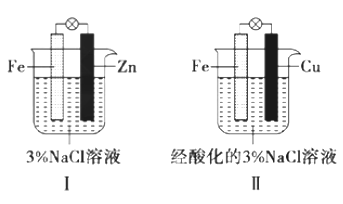
A. I和II中正极均被保护
B. I和II中负极反应均是Fe-2e-=Fe2+
C. I和II中正极反应均是O2+2H2O+4e-=4OH-
D. I和II中分别加入少量氯水和KSCN溶液均变红色
难度: 困难查看答案及解析
-
W、X、Y、Z是四种短周期元素,X、Y处于同一周期,X的原子结构示意图为
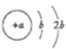 ,Y2-、Z+、W3+的电子层结构相同,下列说法不正确的是
,Y2-、Z+、W3+的电子层结构相同,下列说法不正确的是A. 简单离子半径Y2->Z+>W3+
B. Y、Z形成的化合物一定含有离子键
C. W 的单质是两性物质,既能与酸反应,又能与碱反应
D. X、Y元素形成的离子X2Y42-具有还原性
难度: 困难查看答案及解析
-
常温下,浓度均为1.0mol/L的HX溶液、HY溶液,分别加水稀释.稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是
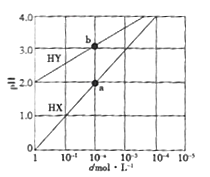
A. HX是强酸,溶液每稀释10倍.pH始终增大l
B. 常温下HY的电离常数为1.0×10-4
C. 溶液中水的电离程度:a 点大于b 点
D. 消耗同浓度的NaOH溶液体积:a 点大于b 点
难度: 困难查看答案及解析